本试题 “小明通过大半学期的化学学习知道了以科学原理和实验事实为依据进行的科学推理,是学习化学的一种重要方法,下列推理得出的相应结论合理的是( )A.物质是由...” 主要考查您对分子的定义
原子的定义
单质和化合物
合金
碳的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 分子的定义
- 原子的定义
- 单质和化合物
- 合金
- 碳的性质
分子结构图:
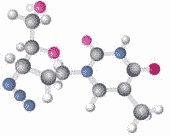
由分子构成的物质:
物质是由粒子构成的,构成物质的粒子有多种,分子是其中的一种。世界上许多物质是由分子构成的,分子可以构成单质,也可以构成化合物。如:氧气、氢气、C60等单质是由分子构成的;水、二氧化碳等化合物也是由分子构成的。
分子的定义:
分子是保持物质化学性质的最小粒子。
分子的构成:


由分子构成的物质:
物质是由粒子构成的,构成物质的粒子有多种,分子是其中的一种。世界上许多物质是由分子构成的,分子可以构成单质,也可以构成化合物。如:氧气、氢气、C60等单质是由分子构成的;水、二氧化碳等化合物也是由分子构成的。
分子的定义:
分子是保持物质化学性质的最小粒子。
概念的理解:
①分子是保持物质化学性质的“最小粒子”、不是“唯一粒子”。
②“保持”的含义是指构成该物质的每一个分子与该物质的化学性质是一致的。
③分子只能保持物质的化学物质,而物质的物理性质(如:颜色、状态等)需要大量的集合体一起来共同体现,单个分子无法体现物质的物理性质。
④“最小”不是绝对意义上的最小,而是”保持物质化学性质的最小”。如果不是在“保持物质化学性质” 这层含义上,分子还可以分成更小的粒子。
用分子的观点解释问题:
物理变化和化学变化的区别
由分子构成的物质,发生物理变化时分子本身未变,分子的运动状态、分子间的间隔发生了改变;发生化学变化时分子本身发生了变化,分子分成原子,原子重新组合变成了共他物质的分子。如:水变成水蒸气,水分子本身没有变,只是分子间的问隔变大,这是物理变化;水通直流电.水分子发生了变化,生成了氢原子和氧原子,氢.原子构成氢分子,氧原子构成氧分子,这是化学变化。
分子的表示方法:
分子可用化学式表示:如O:既可表示氧气,也可表示1个氧分子。
分子的构成:

原子结构示意图:
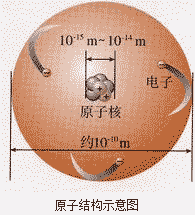
由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。

由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
| 项目 | 分子 | 原子 | |
| 不同点 | 本质区别 | 在化学反应中可以分成原子 | 在化学反应中不能再分 |
| 构成物质情况 | 大多数物质由分子构成 | 原子也能直接构成物质,但分子是由原子构成的 | |
| 相同点 | ①质量和体积都很小 ②都在不停地运动 ③粒子间有间隔 ④都是构成物质的粒子 ⑤同种粒子性质相同,不同种粒子性质不同 | ||
| 注意事项 | ①分子是保持物质化学性质的最小粒子 ②原子是化学变化中的最小粒子 ③分子是由原子构成的 ④对于由原子直接构成的物质,原子是保持其化学性质的最小粒子 | ||
| 联系 | 分子是由原子构成的,分子,原子都是构成物质的粒子,它们的关系是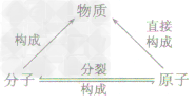 | ||
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。
单质:
(1)概念:由同种元素组成的纯净物。
(2)单质的分类:依据组成单质元素的性质把一单质分为三类。
金属单质:由金属元素组成的单质,如铁、铜、银等
非金属单质:由非金属元素组成的单质,如碳、磷、氧气等
稀有气体单质:由稀有气体元素组成的单质,如氦、氖、氛等单质
化合物:
(1)概念:由不同种元素组成的纯净物。
(2)化合物的分类:化合物分为有机化合物和无机化合物。
单质和化合物的区别和联系:
化合物与氧化物的区别和联系:
同种元素组成的物质一定是单质吗?
由同种元素组成的纯净物叫做单质。理解单质的概念必须抓住两点:①由同种元素组成;②必须是纯净物,如氧气是一单质。由同种元素组成的物质不一定是单质,也可能是混合物,但绝不可能是化合物,如氧气 (O2)、臭氧(O3)两种物质混在一起是一种混合物,但是只有一种氧元素;同样的例子还有红磷和白磷,金刚石和石墨等。
对单质和化合物概念的理解:
(1)单质的概念:
①理解一单质的概念不仅要关注它是由一种元素组成,还应注意它首先是一种纯净物。如:氧气、氮气、碳、硫、铁、铜、各种稀有气体等都属于单质。
②由同种元素组成的物质不一定是单质,还可能是混合物:如:氧气与臭氧的混合物、白磷与红磷的混合物、金刚石与石墨的混合物等都只含一种元素,但都属于混合物。
(2)化合物的概念:理解化合物的概念同样不仅要关注它是由两种或两种以上的元素组成,还应注意它首先是一种纯净物。如二氧化碳,氯化钠、高锰酸钾等都属于化合物。
(1)概念:由同种元素组成的纯净物。
(2)单质的分类:依据组成单质元素的性质把一单质分为三类。
金属单质:由金属元素组成的单质,如铁、铜、银等
非金属单质:由非金属元素组成的单质,如碳、磷、氧气等
稀有气体单质:由稀有气体元素组成的单质,如氦、氖、氛等单质
化合物:
(1)概念:由不同种元素组成的纯净物。
(2)化合物的分类:化合物分为有机化合物和无机化合物。
单质和化合物的区别和联系:
| 单质 | 化合物 | ||
| 区别 | 宏观组成 | 同种元素 | 不同种元素 |
| 微观构成 | 有同种原子构成 | 由不同种原子构成 | |
| 化学性质 | 不能发生分解反应 | 一定条件下发生分解反应 | |
| 联系 | 相互转变 | 它们均属于纯净物。单质发生化合反应可以生成化合物,化合物发生分解反应可以生成单质 | |
| 质子数 | 同一种元素的原子,不论在一单质里还是在化合物里,原子核内质子数保持不变 | ||
化合物与氧化物的区别和联系:
| 化合物 | 氧化物 | |
| 区别 | ①由不同种元素组成的纯净物叫化合物 ②由两种或两种以上元素组成 ③不一定含有氧元素 ④属于纯净物中的一类 |
①由两种元素组成的化合物中,如果有一种元素是氧元素,这种化合物叫氧化物 ②一定由两种元素组成 ③一定含有氧元素 ④属于化合物中的一类 |
| 联系 | 氧化物和化合物是个体与总体的关系,氧化物属于化合物中的一类 | |
同种元素组成的物质一定是单质吗?
由同种元素组成的纯净物叫做单质。理解单质的概念必须抓住两点:①由同种元素组成;②必须是纯净物,如氧气是一单质。由同种元素组成的物质不一定是单质,也可能是混合物,但绝不可能是化合物,如氧气 (O2)、臭氧(O3)两种物质混在一起是一种混合物,但是只有一种氧元素;同样的例子还有红磷和白磷,金刚石和石墨等。
对单质和化合物概念的理解:
(1)单质的概念:
①理解一单质的概念不仅要关注它是由一种元素组成,还应注意它首先是一种纯净物。如:氧气、氮气、碳、硫、铁、铜、各种稀有气体等都属于单质。
②由同种元素组成的物质不一定是单质,还可能是混合物:如:氧气与臭氧的混合物、白磷与红磷的混合物、金刚石与石墨的混合物等都只含一种元素,但都属于混合物。
(2)化合物的概念:理解化合物的概念同样不仅要关注它是由两种或两种以上的元素组成,还应注意它首先是一种纯净物。如二氧化碳,氯化钠、高锰酸钾等都属于化合物。
共价化合物与离子化合物的区别:
1. 共价化合物
(1)概念:像HCl、CO2这样以共用电子对结合在一起的化合物为共价化合物。
(2)共价化合物的类型:
①两种非金属原子结合成的化合物,如HCl、CO2等。
②非金属与酸根构成的化合物,如H2SO4、HNO3等。
2. 离子化合物与共价化合物的区别:
离子化合物是由阴、阳离子相互作用形成的化合物;共价化合物是原子间全部以共用电子对结合形成的化合物。离子化合物由离子构成,共价化合物大多数由分子构成。
合金的概念:
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类
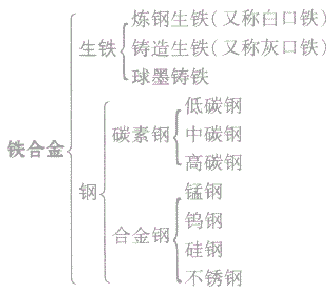
(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
| 含碳量 | 2%—4% | 0.03%—2% |
| 其他元素 | Si、Mn、S、P(少量) | Si、Mn等 |
| 机械性能 | 硬而脆,无韧性 | 坚硬,韧性大,塑性好,有弹性 |
| 机械加工性质 | 可铸不可锻 | 可铸,可锻,可压延 |
| 分类 | 白口铁,灰口铁,球墨铸铁 | 碳素钢,合金钢 |
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类

(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
概述:
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2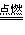 CO2
CO2
氧气不充分的条件下:2C+O2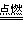 2CO
2CO
3.还原性:
木炭还原氧化铜:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑
3Fe+2CO2↑
木炭与二氧化碳的反应:C+CO2 CO
CO
碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2 CO2
CO2
氧气量不充足时,碳不充分燃烧:2C+O2 2CO
2CO
mg碳与ng氧气反应:
①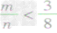 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;
②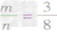 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2;
③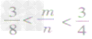 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;
④ 时,恰好完全反应生成CO;
时,恰好完全反应生成CO;
⑤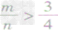 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。
碳单质及其化合物间的转化:
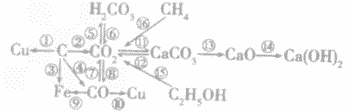
(1)C+2CuO 2Cu+CO2↑
2Cu+CO2↑
(2)C+O2 CO2
CO2
(3)3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
(4)2C+O2 2CO
2CO
(5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2 2CO2
2CO2
(8)C+CO2 2CO
2CO
(9)3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
(10)CO+ 2CuO 2Cu + CO2
2Cu + CO2
(11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3 CaO+CO2
CaO+CO2
(14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
(16)CH4+O2 CO2+2H2O
CO2+2H2O
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2
 CO2
CO2 氧气不充分的条件下:2C+O2
 2CO
2CO 3.还原性:
木炭还原氧化铜:C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ 焦炭还原氧化铁:3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ 焦炭还原四氧化三铁:2C+Fe3O4
 3Fe+2CO2↑
3Fe+2CO2↑ 木炭与二氧化碳的反应:C+CO2
 CO
CO 碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2
 CO2
CO2 氧气量不充足时,碳不充分燃烧:2C+O2
 2CO
2CO mg碳与ng氧气反应:
①
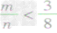 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;②
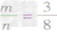 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2; ③
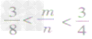 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;④
 时,恰好完全反应生成CO;
时,恰好完全反应生成CO; ⑤
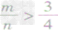 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。 碳单质及其化合物间的转化:

(1)C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ (2)C+O2
 CO2
CO2(3)3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ (4)2C+O2
 2CO
2CO (5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2
 2CO2
2CO2 (8)C+CO2
 2CO
2CO(9)3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 (10)CO+ 2CuO
 2Cu + CO2
2Cu + CO2 (11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3
 CaO+CO2
CaO+CO2 (14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O(16)CH4+O2
 CO2+2H2O
CO2+2H2O 发现相似题
与“小明通过大半学期的化学学习知道了以科学原理和实验事实为依...”考查相似的试题有:
- 用分子、原子的性质解释下列现象:(1)墙内开花墙外香______________;(2)100mL水与100mL酒精混合,所得总体积小于200mL__...
- 某化学实验小组做了如图实验,请回答以下问题.(1)图A所示实验可观察到“铁树”上浸有无色酚酞试液的棉团由白色变为红色,该...
- 要善于从化学的视角认识世界.对下列事实解释错误的是(选项事实解释A墙内开花墙外香分子在不断运动B50L水和50L酒精混合后的...
- 下列物质中前者属于纯净物,后者是单质的是:[ ]A. 碘盐,二氧化碳B. 洁净的空气,氧气C. 高锰酸钾,氮气D. 硫粉,氧化镁
- (1)化学与我们的生活息息相关.请从:A.二氧化硫B.二氧化碳C.氢氧化钠D.碳酸氢钠E.水F.酒精G.石油H.煤八种物质中选...
- 氢是新型清洁能源,但难储运。研究发现,镧和镍的一种合金是储氢材料。下列有关57号元素镧(La)的说法不正确的是( )A.该元...
- (2011年江苏苏州,21题)下列说法错误的是A.碘酒是一种混合物B.水是纯净物,但自然界中几乎不存在纯净的水C.氮气的化学性...
- 如下图所示,图中“○”和“●”分别表示两种质子数不同的原子,其中表示化合物的是:( ) A . B. C. D.
- 下列关于物质的用途与其所依据的性质不符合的是( )A.金刚石用于刻划玻璃----金刚石硬度最大B.活性炭用于冰箱除臭剂----活...
- 碳元素是组成许多物质的基本元素。(1)下列含碳元素的物质中,属于氧化物的是_______(填字母编号)。A.碳酸钙 B.乙醇 C....