本试题 “肉毒碱(化学式:C7H15NO3)被公认为人体必需的营养物质和最佳的减肥营养素.下列关于肉毒碱的叙述错误的是( )A.由四种元素组成B.每个分子中含有26个原子...” 主要考查您对相对原子质量
相对分子质量
物质组成元素的质量分数
元素的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 相对原子质量
- 相对分子质量
- 物质组成元素的质量分数
- 元素的定义
定义:
以一种碳一12原子质量的1/12为标准,其他原子的质量跟它的比值就是这种原子的相对原子质量(符号为A)。
公式:
某原子的相对原子质量=
原子质量与相对原子质量的区别和联系:
对概念的理解:
①相对原子质量只是一个比值,不是原子的实际质量。
②相对原子质最有单位,国际单位为“1”,一般不写也不读。
③相对原子质≈质子数+中子数,只是约等于,可以用于计算。
④碳原子有多种,作为相对原子质量标准的碳原子是原子核中有6个质子和6个中子的碳原子。
⑤只是用这种碳原子实际质量的1/12,而不是这种碳原子的质量。
以一种碳一12原子质量的1/12为标准,其他原子的质量跟它的比值就是这种原子的相对原子质量(符号为A)。
公式:
某原子的相对原子质量=

原子质量与相对原子质量的区别和联系:
| 原子的质量 | 相对原子质量 | |
| 区别 | 测定出来的是原子的实际质量,数值非常小,有单位(kg) | 相比得出的是原子的相对质量,数值大于或等于1,有单位(1) |
| 联系 | 某原子的相对原子质量(Ar) =  | |
对概念的理解:
①相对原子质量只是一个比值,不是原子的实际质量。
②相对原子质最有单位,国际单位为“1”,一般不写也不读。
③相对原子质≈质子数+中子数,只是约等于,可以用于计算。
④碳原子有多种,作为相对原子质量标准的碳原子是原子核中有6个质子和6个中子的碳原子。
⑤只是用这种碳原子实际质量的1/12,而不是这种碳原子的质量。
定义:
相对分子质量就是化学式中各原子的相对原子质量的总和,符号为Mr。如化学式为AmBn的物质的相对分子质量Mr=A的相对原子质量×m+B的相对原子质量×n。
易错易混点:
①化学式中原子团右下角的数字表示其个数(但BaSO4中的4表示氧原子的个数.不表示原子团 SO42-的个数),计算时先求一个原子团的相对质量,再乘以其个数。如Ca(OH)2的相对分子质量=40+(1+16)× 2=74;
②化学式中的圆点,如“CuSO4·5H2O”中的“·” 表示和,不表示积。即CuSO4·5H2O的相对分子质量CuSO4的相对分子质量+H2O的相对分子量×5=160+18×5=250;
③相对分子质量的单位为1,书写时省略不写;
④计算多个相同分子的相对分子质量总和时,应先求出化学式的相对分子质量再乘以前面的系数,如2KClO,的相对分子质量=2×(39+35.5+16×3) =245;
⑤若已知化合物中某原子的相对原子质量A和原了个数n及其质量分数x%,则化合物的相对分子质量=
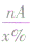
定义:
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=
如AmBn中A元素的质量分数=
若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=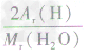 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成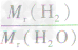 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%
化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例: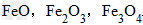 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
解析:三种含铁的氧化物的化学式可变形为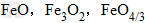 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: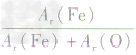 、
、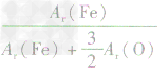 、
、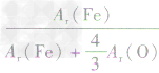 ,通过比较分母可知:
,通过比较分母可知: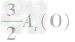 >
>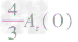 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。
物质中某元素的质量分数,就是该元素的质量与组成物质的各元素总质量之比。
公式:
某元素的质量分数=

如AmBn中A元素的质量分数=

若题目给出物质的化学式,又同时知道物质的实际质量,则可根据物质的质量×某元素的质量分数=该元素的质量,将其中所含元素的质量求出。同理,物质的质量=某元素质量÷该元素的质量分数。
公式的理解:
计算时应先列式计算,然后代入数据算出结果。如水中氢元素的质量分数=
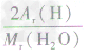 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%而不能写成
×100%=11.1%而不能写成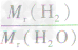 ×100%=
×100%= ×100%=
×100%= ×100%=11.1%
×100%=11.1%化学式中质量分数的应用:
①已知物质的质量求所含的某元素的质量
利用公式:元素的质量=物质的质量×该元素的质量分数
②已知元素的质量求物质的质量
利用公式:物质的质量=元素的质量÷该元素的质量分数
③根据元素的质量分数确定物质的化学式
利用化学式的变形比较元素质量分数的大小:
例:
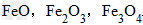 三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?
三种铁的氧化物按铁元素的质量分数由大到小排列的顺序为?解析:三种含铁的氧化物的化学式可变形为
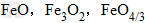 ,则三种含铁的氧化物中铁元素的质量分数分别为:
,则三种含铁的氧化物中铁元素的质量分数分别为: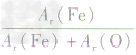 、
、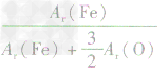 、
、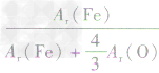 ,通过比较分母可知:
,通过比较分母可知: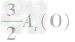 >
>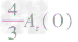 >Ar(O),故铁元素的质量分数由大到小排列的顺序为
>Ar(O),故铁元素的质量分数由大到小排列的顺序为 。
。概念:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
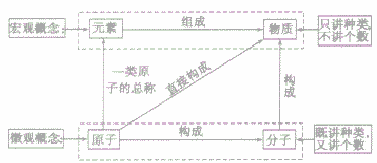
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;
在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
| 元素 | 原子 | |
| 概念 | 具有相同核电荷数〔即核内质子数)的一类原子的总称 | 化学变化中的最小粒子 |
| 区分 | 只讲种类,不讲个数 | 既讲种类,又讲个数 |
| 使用范围 | 用于描述物质的宏观组成 | 用于描述物质的微观构成 |
| 举例 | 水由氢元素和氧元素组成,或说水中含有氢元素和氧元素 | 每个水分子由两个氢原子和一个氧原子构成 |
| 联系 | 元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称一种元素可以包含几种原子 | |
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;

在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
发现相似题
与“肉毒碱(化学式:C7H15NO3)被公认为人体必需的营养物质和最...”考查相似的试题有:
- 市售某种氮肥中,主要成分为尿素[化学式为:CO(NH2)2]若含量在96%以上为达标一级产品.请回答:(1)尿素的相对分子质量是_...
- 闪电时空气中有臭氧(O3)生成.下列说法中正确的是( )A.O3和O2混合得到的是纯净物B.O3与O2的相互转化是物理变化C.等质...
- 碳酸氢铵(NH4HCO3)是农村中常用的化肥,现将50千克碳酸氢铵配成质量分数为5%的碳酸氢铵溶液,给农作物施肥.试计算:(1)5...
- 我省是大蒜的重要产地,大蒜除可食用外,还有药用价值.大蒜中大蒜青素的化学式为C6H10S2.下列关于大蒜青素的有关说法错误的...
- 丁酸乙酯(化学式为C6H12O2)是一种无色、具有菠萝香味的液体,常用作食品、饮料的调香剂。根据丁酸乙酯的化学式计算:(1)丁...
- 味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na)。某品牌味精包装上标注内容如图所示,请...
- 已知氮肥尿素的化学式为[CO(NH2)2],试计算下列各题。(1)计算尿素中C、O、N、H各元素的质量比。(2)若某块庄稼地中的作物...
- 据报道,目前在欧美等发达国家已基本采用新一代广谱、高效、无污染的饮用水消毒剂二氧化氯(ClO2).用电解法制备ClO2的装置...
- “以崇尚科学为荣,以愚昧无知为耻”.下列叙述或做法缺乏科学依据的是( )A.夜晚发现煤气泄漏立即开窗通风B.利用稀盐酸可除...
- 继1985年科学家发现了C60分子后,1991年科学家又发现了一种管状的碳单质--碳纳米管.请你用所学知识回答下列问题.(1)在常...