本试题 “(每空2分,共10分)益阳市生产的松花皮蛋全国闻名。将水、生石灰、纯碱、食盐按100∶11.2∶5.3∶3.5的质量比混合而成料浆,将鲜鸭蛋粘上料浆密封一段时间即可得...” 主要考查您对实验室制取和收集气体的思路
二氧化碳的性质实验
化学实验数据的分析
家庭小实验、趣味实验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 实验室制取和收集气体的思路
- 二氧化碳的性质实验
- 化学实验数据的分析
- 家庭小实验、趣味实验
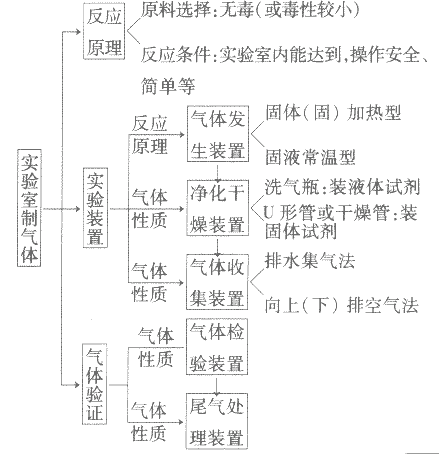
实验室制取气体的思路:
1.知识要点详解在初中化学中,主要应掌握O2、H2、CO2的实验室制法。可以从制备所需仪器、药品、反应原理、收集方法、实验装置、验满、验纯及操作要点等方面进行比较。通过比较,能够总结和归纳实验室制取气体的思路。即:研究反应原理一根据所选药品的状态和反应条件,选择适当的仪器组成相应的实验装置一根据实验装置的特点,设计合理的实验操作步骤,预测可能的注意事项一根据所制取气体的性质,选择相应的收集、检验、验满及验纯的方法。
实验室制取气体及验证其性质的实验,属于基本操作的简单综合实验。通过对比发生装置和收集装置,总结气体的个性及几种气体的共性,提高记忆效果。
2.设计装置的依据制取气体的装置分两部分:气体发生装置和气体收集装置。
发生装置的选取根据反应条件和反应物的状态而设计,收集装置是根据气体的性质(主要是物理性质)而确定的。
确定收集装置的原则——气体的收集方法是由该气体的性质,如密度、在水中的溶解性、是否与空气或水反应、是否有毒等决定的。
气体发生装置:
①“固+固 ”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。
”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。
②“固+液 ”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。
”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。

③“固+液 ”的反应的发生装置的其他改进:
”的反应的发生装置的其他改进:
为了节约药品,方便操作,可设计如下图所示装置,这些装置都可自动控制。
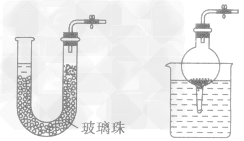
当打开弹簧夹时,溶液进入反应器内开始反应;当关闭弹簧夹时,气路不通,反应产生的气体将溶液压出反应器外,液体与同体分离,反应停止。
气体收集装置:
药品的选取和实验方案的设计:
(1)可行性:所选取的药品能制得要制取的气体;
(2)药品廉价易得;
(3)适宜的条件:要求反应条件易达到,便于控制;
(4)反应速率适中:反应速率不能太快或太慢,以便于收集或进行实验;
(5)气体尽量纯净;
(6)注意安全性:操作简便易行,注意防止污染。
例如:①实验室制取H2时选用锌粒,而不用镁条、铁片,原因是镁价格贵且反应速率太快而铁反应速率又太慢;酸选用稀硫酸,而不宜用稀盐酸、浓硫酸,因为用稀盐酸制得的H2,因混有HCl而不纯,而锌与浓硫酸反应不生成H2.
②制CO2时可选用用石灰石(或大理石)与稀盐酸,而不选用Na2CO3浓盐酸、稀硫酸,原因是Na2CO3,反应速率太快,浓盐酸易挥发出HCl气体,稀硫酸反应不能进行到底,也不能煅烧石灰石,因为条件不易达到,不呵操作;
④用KClO3、过氧化氢制O2时,要加少量的MnO2,作催化剂,以加快反应的速率
实验室制取气体的实验操作程序:
实验室制取气体存选择好药品、仪器后操作的一般程序:
(1)组装仪器:一般按从左到右,从下到上的顺序进行;
(2)检查装置气密;
(3)装药品:若是固体跟液体反应,一般是是先装入固体再加入液体;
(4)准备收集装置:若用排水法收集气体时,应在制取气体之前将集气瓶盛满水;
(5)制取气体;
(6)收集气体并验满;
(7)拆洗仪器。
注意:①给同体加热时.试管口要略向下倾斜;
②用加热KMnO4或KClO3(MnO2作催化剂)的方法制取O2,若用排水法收集,实验完毕时应先把导管移出水槽再移走酒精灯;
③固体跟液体反应制取气体时,要注意长颈漏斗末端要插入液面以下进行液封,以防漏气。
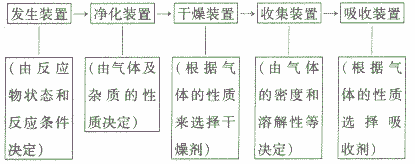
装置的选取与连接:
实验室制取气体的实验往往与气体的净化、气体的干燥综合在一起。气体综合实验的装置选择及连接顺序为:
气体净化的几种方法:
(1)吸收法:用吸收剂将杂质气体吸收除去。如除去CO中混有的少量CO2,可先用浓NaOH溶液吸收CO2,再用浓硫酸等干燥剂除去水蒸气。常用吸收剂如下表:
(2)转化法:通过化学反血,将杂质气体转化为所要得到的气体:如除去CO2中的CO,可将混合气体通过足量的灼热CuO+CO Cu+CO2
Cu+CO2
气体的干燥:
气体的干燥是通过干燥剂来实现的,选择干燥剂要根据气体的性质。一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂的状念决定.
(1)常见的干燥剂
(2)干燥装置的选择
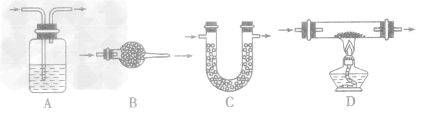
①除杂试剂为液体时,常选用洗气瓶,气体一般是 “长进短出”,如下图A。
②除杂试剂为同体时,常选用干燥管(球形或u 形),气体一般是“大进小出”,如下图B、C。
③需要通过加热与固体试剂发生化学反应除去的气体,常采用硬质玻璃管和酒精灯,如下图D。
装置连接顺序的确定规律:
(1)除杂和干燥的先后顺序
①若用洗气装置除杂,一般除杂在前,干燥在后。原因:从溶液中出来的气体通常混有水蒸气,干燥在后可将水蒸气完全除去。如除去CO中混有的CO2和水蒸气,应将气体先通过。NaOH溶液,再通过浓H2SO4。
②若用加热装置除杂,一般是干燥在前,除杂在后。如除去CO2中混有的CO和水蒸气,应将气体先通过浓H2SO4,再通过灼热的CuO。
(2)除去多种杂质气体的顺序一般是先除去酸性较强的气体。如N2中混有 HCl、H2O(气)、O2时,应先除去HCl,再除去水,最后除去O2(用灼热的铜网)。
(3)检验多种气体的先后顺序(一般先验水蒸气):有多种气体需要检验时,应尽量避免前步检验对后步检验的干扰。如被检验的气体中含有CO2和水蒸气时,应先通过无水CuSO4。检验水蒸气,再通过澄清的石灰水检验CO2.
确定气体收集方法的技巧:
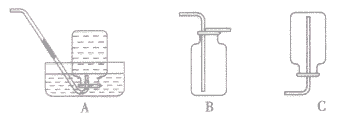
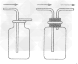
(1)排水集气法适用于“不溶于水且小与水反应的气体”,如下图A。
(2)向上排空气法适用于“密度比空气大且小与空气成分反应的气体”(相对分子质量大于29的气体),如下图B。
(3)向下排空气法适用于“密度比空气小且小与空气成分反应的气体”(相对分子质量小于29的气体),如下图C。
(4)不能用排空气法收集的气体
①气体的密度与空气的密度相近时不能用排空气法收集
②当气体与空气中某一成分反应时不能用排空气法收集
(5)有毒气体收集方法的确定
①有毒,但气体难溶于水时,一般采用排水法收集。如下图D
②有毒,但气体叉易溶于水时,则采用带双孔胶塞(一长一短的导气管)的集气瓶利用排空气法收集该气体,但必须接尾气处理装置,以免多余的有毒气体逸散到空气中污染空气,如收集氨气可用图E。

气体制取实验中关于仪器或装置选择题目的解题技巧:
(1)需要研究气体实验室制法的化学反应原理;
(2)需要研究制取这种气体所应采用的实验装置;
(3)需要研究如何证明制得的气体就是要制取的气体。
根据给出的仪器或装置进行选取时,应明确制取气体的发生装置主要是两套(同体加热型和固液常温型),依据反应物的状态和反应条件来确定选用哪套发生装置;气体的收集装置主要就是三套(向上排空气法、向下排空气法和排水法),依据气体的性质来确定选用什么样的收集装置。选择仪器时要注意先对实验原理进行判断,然后再根据原理确定装置所需要的仪器。
实验室制取气体的思路图:
1.知识要点详解在初中化学中,主要应掌握O2、H2、CO2的实验室制法。可以从制备所需仪器、药品、反应原理、收集方法、实验装置、验满、验纯及操作要点等方面进行比较。通过比较,能够总结和归纳实验室制取气体的思路。即:研究反应原理一根据所选药品的状态和反应条件,选择适当的仪器组成相应的实验装置一根据实验装置的特点,设计合理的实验操作步骤,预测可能的注意事项一根据所制取气体的性质,选择相应的收集、检验、验满及验纯的方法。
实验室制取气体及验证其性质的实验,属于基本操作的简单综合实验。通过对比发生装置和收集装置,总结气体的个性及几种气体的共性,提高记忆效果。
2.设计装置的依据制取气体的装置分两部分:气体发生装置和气体收集装置。
发生装置的选取根据反应条件和反应物的状态而设计,收集装置是根据气体的性质(主要是物理性质)而确定的。
确定收集装置的原则——气体的收集方法是由该气体的性质,如密度、在水中的溶解性、是否与空气或水反应、是否有毒等决定的。
气体发生装置:
①“固+固
 ”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。
”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。 ②“固+液
 ”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。
”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。 
③“固+液
 ”的反应的发生装置的其他改进:
”的反应的发生装置的其他改进:为了节约药品,方便操作,可设计如下图所示装置,这些装置都可自动控制。

当打开弹簧夹时,溶液进入反应器内开始反应;当关闭弹簧夹时,气路不通,反应产生的气体将溶液压出反应器外,液体与同体分离,反应停止。
气体收集装置:
| 收集装置 | 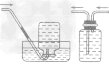 |
 |
 |
| 选择条件 | 难溶或微溶于水,与水不发生化学反应的气体。如:H2、 O2、CH4等 | 不与空气发生反应,密度比空气密度大的气体。如:O2、 CO2等 | 不与空气发生反应,密度比空气密度小的气体。如:H2、CH4等 |
| 说明 | ①使用排水法收集的气体较纯净,但缺点是会使收集的气体中禽有水蒸气。当导管口有连续均匀的气泡冒出时才开始收集,当有大量气泡从集气瓶口冒出时,表明气体已收集满。 ②用向上排空气法收集气体,应注意将导管伸到接近集气瓶瓶底,同时应在瓶口盖上玻璃片,以便尽可能地排尽空气,提高所收集气体的纯度。使用排空气法收集的气体比较十燥,但纯度较低,需要验满(可燃性气体则要注意安全,点燃之前一定要验纯,否则有爆炸危险) | ||
药品的选取和实验方案的设计:
(1)可行性:所选取的药品能制得要制取的气体;
(2)药品廉价易得;
(3)适宜的条件:要求反应条件易达到,便于控制;
(4)反应速率适中:反应速率不能太快或太慢,以便于收集或进行实验;
(5)气体尽量纯净;
(6)注意安全性:操作简便易行,注意防止污染。
例如:①实验室制取H2时选用锌粒,而不用镁条、铁片,原因是镁价格贵且反应速率太快而铁反应速率又太慢;酸选用稀硫酸,而不宜用稀盐酸、浓硫酸,因为用稀盐酸制得的H2,因混有HCl而不纯,而锌与浓硫酸反应不生成H2.
②制CO2时可选用用石灰石(或大理石)与稀盐酸,而不选用Na2CO3浓盐酸、稀硫酸,原因是Na2CO3,反应速率太快,浓盐酸易挥发出HCl气体,稀硫酸反应不能进行到底,也不能煅烧石灰石,因为条件不易达到,不呵操作;
④用KClO3、过氧化氢制O2时,要加少量的MnO2,作催化剂,以加快反应的速率
实验室制取气体的实验操作程序:
实验室制取气体存选择好药品、仪器后操作的一般程序:
(1)组装仪器:一般按从左到右,从下到上的顺序进行;
(2)检查装置气密;
(3)装药品:若是固体跟液体反应,一般是是先装入固体再加入液体;
(4)准备收集装置:若用排水法收集气体时,应在制取气体之前将集气瓶盛满水;
(5)制取气体;
(6)收集气体并验满;
(7)拆洗仪器。
注意:①给同体加热时.试管口要略向下倾斜;
②用加热KMnO4或KClO3(MnO2作催化剂)的方法制取O2,若用排水法收集,实验完毕时应先把导管移出水槽再移走酒精灯;
③固体跟液体反应制取气体时,要注意长颈漏斗末端要插入液面以下进行液封,以防漏气。
装置的选取与连接:
实验室制取气体的实验往往与气体的净化、气体的干燥综合在一起。气体综合实验的装置选择及连接顺序为:

气体净化的几种方法:
(1)吸收法:用吸收剂将杂质气体吸收除去。如除去CO中混有的少量CO2,可先用浓NaOH溶液吸收CO2,再用浓硫酸等干燥剂除去水蒸气。常用吸收剂如下表:
| 吸收剂 | 吸收的气体杂质 | 吸收剂 | 吸收的气体杂质 |
| 水 | 可溶性的气体:HCl,NH3 | NaOH | CO2,HCl,H2O |
| 无水CuSO4 | H2O | 碱石灰 | CO2,HCl ,H2O |
| 灼热的铜网 | O2 | NaOH | CO2,HCl |
| 灼热的CuO | H2,CO | 浓硫酸 | H2O |
 Cu+CO2
Cu+CO2气体的干燥:
气体的干燥是通过干燥剂来实现的,选择干燥剂要根据气体的性质。一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂的状念决定.
(1)常见的干燥剂
| 干燥剂 | 可干燥的气体 | 不可干燥的气体 | ||
| 名称或化学式 | 酸碱性 | 状态 | ||
| 浓H2SO4 | 酸性 | 液体 | H2、N2、O2、CO2、HCl、CH4、CO | NH3 |
| 固体NaOH、生石灰,碱石灰(氢氧化钠和生石灰的混合物) | 碱性 | 固态 | H2、O2、N2、CH4、CO、NH3等 | CO2、SO2、HCl |
| 无水CaCl2 | 中性 | 固态 | 除NH3外的所有气体 | NH3 |
(2)干燥装置的选择
①除杂试剂为液体时,常选用洗气瓶,气体一般是 “长进短出”,如下图A。
②除杂试剂为同体时,常选用干燥管(球形或u 形),气体一般是“大进小出”,如下图B、C。
③需要通过加热与固体试剂发生化学反应除去的气体,常采用硬质玻璃管和酒精灯,如下图D。

装置连接顺序的确定规律:
(1)除杂和干燥的先后顺序
①若用洗气装置除杂,一般除杂在前,干燥在后。原因:从溶液中出来的气体通常混有水蒸气,干燥在后可将水蒸气完全除去。如除去CO中混有的CO2和水蒸气,应将气体先通过。NaOH溶液,再通过浓H2SO4。
②若用加热装置除杂,一般是干燥在前,除杂在后。如除去CO2中混有的CO和水蒸气,应将气体先通过浓H2SO4,再通过灼热的CuO。
(2)除去多种杂质气体的顺序一般是先除去酸性较强的气体。如N2中混有 HCl、H2O(气)、O2时,应先除去HCl,再除去水,最后除去O2(用灼热的铜网)。
(3)检验多种气体的先后顺序(一般先验水蒸气):有多种气体需要检验时,应尽量避免前步检验对后步检验的干扰。如被检验的气体中含有CO2和水蒸气时,应先通过无水CuSO4。检验水蒸气,再通过澄清的石灰水检验CO2.
确定气体收集方法的技巧:
(1)排水集气法适用于“不溶于水且小与水反应的气体”,如下图A。
(2)向上排空气法适用于“密度比空气大且小与空气成分反应的气体”(相对分子质量大于29的气体),如下图B。
(3)向下排空气法适用于“密度比空气小且小与空气成分反应的气体”(相对分子质量小于29的气体),如下图C。

(4)不能用排空气法收集的气体
①气体的密度与空气的密度相近时不能用排空气法收集
②当气体与空气中某一成分反应时不能用排空气法收集
(5)有毒气体收集方法的确定
①有毒,但气体难溶于水时,一般采用排水法收集。如下图D
②有毒,但气体叉易溶于水时,则采用带双孔胶塞(一长一短的导气管)的集气瓶利用排空气法收集该气体,但必须接尾气处理装置,以免多余的有毒气体逸散到空气中污染空气,如收集氨气可用图E。

气体制取实验中关于仪器或装置选择题目的解题技巧:
(1)需要研究气体实验室制法的化学反应原理;
(2)需要研究制取这种气体所应采用的实验装置;
(3)需要研究如何证明制得的气体就是要制取的气体。
根据给出的仪器或装置进行选取时,应明确制取气体的发生装置主要是两套(同体加热型和固液常温型),依据反应物的状态和反应条件来确定选用哪套发生装置;气体的收集装置主要就是三套(向上排空气法、向下排空气法和排水法),依据气体的性质来确定选用什么样的收集装置。选择仪器时要注意先对实验原理进行判断,然后再根据原理确定装置所需要的仪器。
实验室制取气体的思路图:

探究二氧化碳的三个性质实验:
1.证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
2.二氧化碳溶于水显酸性
3.二氧化碳能溶于水
二氧化碳性质探究实验:
1.证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
(1)装置: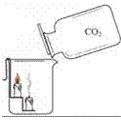
(2)现象:蜡烛由低到高依次熄灭
结论:证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
2.二氧化碳溶于水显酸性
(1)装置:
(2)现象:1和4实验中的白花变红,2和3白花不变色
(3)结论:二氧化碳不能使紫色石蕊试液变红,二氧化碳的水溶液能使紫色石蕊试液变红。
(或二氧化碳溶于水显酸性)
3.二氧化碳能溶于水
(1)装置: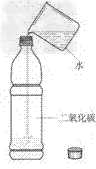
(2)现象:塑料瓶变瘪
(3)结论:二氧化碳能溶于水。
1.证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
2.二氧化碳溶于水显酸性
3.二氧化碳能溶于水
二氧化碳性质探究实验:
1.证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
(1)装置:

(2)现象:蜡烛由低到高依次熄灭
结论:证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
2.二氧化碳溶于水显酸性
(1)装置:

(2)现象:1和4实验中的白花变红,2和3白花不变色
(3)结论:二氧化碳不能使紫色石蕊试液变红,二氧化碳的水溶液能使紫色石蕊试液变红。
(或二氧化碳溶于水显酸性)
3.二氧化碳能溶于水
(1)装置:

(2)现象:塑料瓶变瘪
(3)结论:二氧化碳能溶于水。
实验过程中的各种测量数据及有关现象,应及时准确而清楚地记录下来。记录实验数据时,要有严谨的科学态度,要实事求是,切忌夹杂主观因素,决不能随意拼凑或伪造数据。
常见的易混易错的数据:
1. 托盘天平称量的质量只能精确到小数点后1位。
2. 量筒测量溶液的体积,精确到小数点后1位。
3. 温度计测量的温度数据精确到小数点后1位。
4. pH试纸测量溶液的pH值只能精确到整数位。
常见的易混易错的数据:
1. 托盘天平称量的质量只能精确到小数点后1位。
2. 量筒测量溶液的体积,精确到小数点后1位。
3. 温度计测量的温度数据精确到小数点后1位。
4. pH试纸测量溶液的pH值只能精确到整数位。
“家庭小实验”是指利用家庭生活用品来进行化学实验,从而对化学进行学习和探讨的活动。它具有趣味性、探究性、规范性、普及性等特点。
常见的家庭小实验:
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
(10)
(11)
(12)
(13)
(14)
(15)
常见的家庭小实验:
(1)
| 序号 | 1 |
| 实验名称 | 点不着的“纸” |
| 家庭用到的实验器材及药品 | 铜棒两张相同的长条白纸火柴 |
| 实验步骤 | 1、用火柴直接点其中的一张纸条; 2、将另一张纸条先以螺旋形紧紧地缠绕在铜棒上,再去点燃; |
| 实验现象 | 1、纸条迅速燃烧 2、纸条没有燃烧 |
| 实验结论 | 因为铜具有良好的导热性,将加热处的热量迅速传导散失,使其温度达不到纸条的着火点而点不着。 |
| 注意事项 | 铜棒是金属,有良好的导热性,注意勿烫手。 |
(2)
| 序号 | 2 |
| 实验名称 | “神奇”的手帕 |
| 家庭用到的实验器材及药品 | 酒精的水溶液(1:1)棉手帕钳子(两只)火柴 |
| 实验步骤 | 把棉手帕放入用酒精与水以1:1配成的溶液里浸透,然后轻挤,用两只钳子分别夹住手帕两角,放到火上点燃,等火焰减小时迅速摇动手帕,使火焰熄灭。 |
| 实验现象 | 手帕依旧完好如初。 |
| 实验结论 | 燃烧时,酒精的火焰在水层外,吸附在纤维空隙里的水分吸收燃烧放出的热量而蒸发,手帕上的温度达不到纤维的着火点,因而手帕烧不坏。 |
| 注意事项 | 由于火焰温度较高,注意别烧伤手及对着其他人,且远离其它可燃物。 |
(3)
| 序号 | 3 |
| 实验名称 | 金属性质“谁更强” |
| 家庭用到的实验器材及药品 | 白醋、铝片、铁片、铜片、剪刀、砂纸、玻璃杯 |
| 实验步骤 | 1、用三个小玻璃杯各取适量白醋,用砂纸把三种金属打磨光亮,再用剪刀剪三种金属少量分别加入白醋中; 2、用剪过剩下的铝片放入放铁的杯子中,充分振荡; |
| 实验现象 | 1、放铝和铁的杯子中产生气泡,放铜的杯子中没有,且放铁的杯子中溶液颜色变为浅绿色; 2、铝片表面出现灰黑色固体,且溶液颜色由浅绿色变为无色; |
| 实验结论 | 1、铝和铁的活动性都比铜强; 2、铝的活动性大于铁;所以:铝>铁>铜 |
| 注意事项 | 观察颜色的变化要仔细呦! |
(4)
| 序号 | 4 |
| 实验名称 | 自制碳酸饮料 |
| 家庭用到的实验器材及药品 | 凉开水250克、柠檬汁1.5克、白糖8克、小苏打(NaHCO3)1.5克、500ml饮料瓶、适量果汁 |
| 实验步骤 | 1、在约500mL的饮料瓶中加入约8克白糖和适量果汁;2、加入约1.5g小苏打;3、注入凉开水;4、再加入约1.5g柠檬汁;5、立即旋紧瓶盖,摇匀,放入冰箱。半小时后,你就可以喝到清凉甘甜的汽水了。 |
| 实验现象 | 1、产生气泡; 2、气泡消失。 |
| 实验结论 | 1、碳酸氢钠与柠檬酸反应,生成二氧化碳; 2、二氧化碳与水反应生成碳酸,即碳酸饮料。 |
| 注意事项 | 原料的量,根据口味不同,适当可以调整呦! |
(5)
| 序号 | 5 |
| 实验名称 | “切断”的烛焰 |
| 家庭用到的实验器材及药品 | 粗铜丝(多股)蜡烛火柴 |
| 实验步骤 | 1、用粗铜丝绕成一个内径比蜡烛直径稍小点的线圈,圈与圈之间需有一定的空隙;2、点燃蜡烛,把铜丝制成的线圈放在火焰的中间。 |
| 实验现象 | 铜圈上方的火焰被“切断”,下方的火焰正常燃烧。 |
| 实验结论 | 铜具有良好的导热能力。当铜丝罩在蜡烛火焰的中间时,上方火焰的热量被铜丝带走,使蜡烛火焰上方的温度低于其着火点,上方火焰就熄灭了。 |
| 注意事项 | 小心烫手呦! |
(6)
| 序号 | 6 |
| 实验名称 | 瓶“吃”鸡蛋 |
| 家庭用到的实验器材及药品 | 熟鸡蛋白醋广口瓶蘸有酒精的棉球火柴镊子 |
| 实验步骤 | 1、将熟鸡蛋浸在白醋中,待鸡蛋壳变软后,将蛋取出;2、找一个瓶口略比鸡蛋小的广口瓶,往广口瓶中投入一燃着的酒精棉球,迅速将鸡蛋的小头对准瓶口。 |
| 实验现象 | 1、鸡蛋壳表面产生许多气泡; 2、鸡蛋很快被吸入瓶中。 |
| 实验结论 | 酒精燃烧消耗瓶中氧气,瓶中压强低于外界大气压,外界气压把鸡蛋压入瓶中。 |
| 注意事项 | 注意鸡蛋放入瓶口的时机;瓶中的鸡蛋可能会变硬。 |
(7)
| 序号 | 7 |
| 实验名称 | 水变“汽水” |
| 家庭用到的实验器材及药品 | 白醋(CH3COOH)碱面(Na2CO3)自来水玻璃棒细玻璃杯 |
| 实验步骤 | 1、取适量碱面溶于水,用玻璃棒搅拌,形成澄清液体;2、倒入白醋。 |
| 实验现象 | 可看到有大量气泡从液体中涌出,犹如“汽水”一般。 |
| 实验结论 | 碳酸钠与醋酸反应生成二氧化碳气体。 |
| 注意事项 | 白醋与碱面的量,可以自己控制呦! |
(8)
| 序号 | 8 |
| 实验名称 | 水变“牛奶” |
| 家庭用到的实验器材及药品 | 碱面生石灰自来水玻璃棒细玻璃杯 |
| 实验步骤 | 1、取适量碱面和生石灰,分别溶于水,用玻璃棒搅拌,取上层清液于两细玻璃杯中;2、把一细玻璃杯中的液体倒入另一细玻璃杯中。 |
| 实验现象 | 产生像“牛奶”一样的白色浑浊。 |
| 实验结论 | 1、生石灰与水反应生成氢氧化钙; 2、碳酸钠与氢氧化钙反应生成碳酸钙,碳酸钙难溶于水。 |
| 注意事项 | 因为石灰有腐蚀性,在配制石灰水时,注意安全,防止溅到皮肤、衣服,特别是眼睛。 |
(9)
| 序号 | 9 |
| 实验名称 | 硬、软水检验 |
| 家庭用到的实验器材及药品 | 洗洁精家用饮水玻璃杯筷子 |
| 实验步骤 | 1、用玻璃杯取小半杯家用饮水; 2、挤倒5-6滴洗洁精,用筷子搅拌; |
| 实验现象 | 1、若产生大量泡沫,且无垢状物; 2、若几乎没有泡沫,且产生许多垢状物; |
| 实验结论 | 1、家用饮水是软水; 2、家用饮水是硬水。 |
| 注意事项 | 洗洁精也可用肥皂水代替。 |
(10)
| 序号 | 10 |
| 实验名称 | 瓶“吐”鸡蛋 |
| 家庭用到的实验器材及药品 | 吸滤瓶(可到化学仪器商店购买)去壳熟鸡蛋注射器胶皮管纯碱(Na2CO3)白醋 |
| 实验步骤 | 1、把去壳熟鸡蛋放入口径比鸡蛋略小的吸滤瓶中,让鸡蛋堵住瓶口,保持瓶口向下;2、用注射器从导管注入饱和Na2CO3溶液;3、再用注射器注入白醋; |
| 实验现象 | 1、会产生许多气泡; 2、鸡蛋被吐了出来。 |
| 实验结论 | Na2CO3溶液与醋酸反应产生二氧化碳,使瓶中的压强增大,把鸡蛋压出来。 |
| 注意事项 | Na2CO3溶液和白醋的量尽可能多一些。 |
(11)
| 序号 | 11 |
| 实验名称 | 鸡蛋“煮熟”之谜 |
| 家庭用到的实验器材及药品 | 鸡蛋玻璃杯生石灰(CaO)自来水 |
| 实验步骤 | 在玻璃杯里放入适量生石灰粉末,鸡蛋放在上面,然后倒水浸没鸡蛋。 |
| 实验现象 | 产生大量白雾;过一会儿,鸡蛋被煮熟。 |
| 实验结论 | CaO与水反应生成熟石灰Ca(OH)2,同时放出大量的热量。 |
| 注意事项 | 1Kg氧化钙和水反应,产生的热量可以烧开近两热水瓶的水。 |
(12)
| 序号 | 12 |
| 实验名称 | 自制喷泉 |
| 家庭用到的实验器材及药品 | 稀硫酸锌片红墨水广口瓶(两个)导管尖嘴玻璃管胶皮管长颈漏斗橡皮塞 |
| 实验步骤 | 取两只广口瓶,按图示装配好,右瓶的水中滴几滴红墨水,左瓶中放入锌片,从长颈漏斗中注入稀硫酸。 |
| 实验现象 | 左瓶中产生气泡;尖嘴玻璃管处像喷泉一样喷出红色的水。 |
| 实验结论 | 稀硫酸与锌反应生成氢气,氢气难溶于水,右瓶中压强增大,把水压进玻璃管中,形成喷泉。 |
| 注意事项 | 装置不能漏气;长颈漏斗下端要浸没在液体以下。 |
(13)
| 序号 | 13 |
| 实验名称 | 铁树“开花” |
| 家庭用到的实验器材及药品 | 铁丝果导片浓氨水棉球 |
| 实验步骤 | 1、把果导片捣碎,加入足量水,搅拌,静置,取上层液体得酚酞试液;2、把铁丝编成树状,把沾有酚酞的棉球挂在铁树枝上;3、把铁树放在敞口的盛有浓氨水的瓶口上方。 |
| 实验现象 | 一会儿,可看到棉球变成了红色,整个铁树就像开花了一样。 |
| 实验结论 | 浓氨水有强烈的挥发性,挥发出的氨气使无色酚酞试液变红。 |
| 注意事项 | 浓氨水挥发出的氨气有毒,尽量带上口罩。 |
(14)
| 序号 | 14 |
| 实验名称 | 变“瘪”的瓶子 |
| 家庭用到的实验器材及药品 | 雪碧饮料塑料瓶水带导管的单孔橡皮塞 |
| 实验步骤 | 1、在塑料瓶里放入约1/3的水;2、用带导管的单孔橡皮塞塞住雪碧瓶口,导管另一端放进塑料瓶里;3、一段时间后,盖紧瓶盖,用力振荡塑料瓶。 |
| 实验现象 | 塑料瓶变瘪了。 |
| 实验结论 | 雪碧饮料里产生大量气泡,那是二氧化碳,与水反应后,塑料瓶内的压强减小,外界气压把塑料瓶子压瘪了。 |
| 注意事项 | 向塑料瓶里通气体的时间要长一些,必要时可轻轻摇晃雪碧瓶。 |
(15)
| 序号 | 15 |
| 实验名称 | 巧除水垢 |
| 家庭用到的实验器材及药品 | 白醋炊壶(内有大量的“茶碱”)清水 |
| 实验步骤 | 取一内有大量“茶碱”的炊壶,向里倒入约50—100毫升白醋,左右旋转炊壶,让白醋接触“茶碱”,过一会,用较多的清水冲洗。 |
| 实验现象 | 1、“茶碱”处产生许多气泡; 2、“茶碱”逐渐脱落。 |
| 实验结论 | “茶碱”不溶于水,但能与醋酸反应,生成二氧化碳气体和能溶于水的物质,被清水冲洗掉。 |
| 注意事项 | 用白醋浸泡的时间不宜太长,防止与铝或铁反应损坏炊壶。 |
发现相似题
与“(每空2分,共10分)益阳市生产的松花皮蛋全国闻名。将水、生...”考查相似的试题有:
- 下图是同学们探究过的几个重要实验,仔细观察,回答下列问题:( l )图 1 是测定空气中氧气含量的实验。在实验过程中,观察到...
- 如下图所示,在小烧杯乙和丙内分别放入不同的物质后,立即用大烧杯甲罩住小烧杯乙和丙。下列有关实验现象正确的是 烧杯乙烧杯...
- 某校“我与化学”活动小组通过查阅资料了解到,我国超市每年消耗约40万吨塑料袋,假定这些使用后的废塑料袋都通过焚烧处理,将...
- 某化学课外活动小组在实验室配制石灰水时,发现烧杯底部仍有固体未溶解,对熟石灰样品的主要成分进行了探究。请你参与讨论并...
- (7分)通常人们蒸馒头都是在发酵的面粉中加入适量的纯碱(Na2CO3)而小明同学发现妈妈今天蒸馒头并没有“发面”,而是在面粉中...
- 在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组提出可以用含铜废料制备胆矾(CuSO4·XH...
- 在生产生活中,你会发现“化学就在身边”.(1)洗洁精清除油污,这时利用它的 作用.(2)上海世博园内安装的“直饮水”机,采用...
- (6分)试用你所学过的化学知识解释下列问题或现象。(1)食品密封包装时填充氮气可以防腐,这是因为 。(2)煤矿矿井内严禁...
- 按图中所标要求组装好的以下Ⅰ~Ⅲ装置,搁置一段时间后,观察所产生的现象,下列有关叙述正确的是( )I II IIIA.Ⅰ、II装置中...
- 化学时刻影响着我们的生活,它在工农业生产和日常生活中起到了非常重要的作用。下列说法正确的是A.铁元素是人体必需的常量元...