本试题 “下列说法正确的是( )A.用50g溶质质量分数为10%的NaCl溶液配制溶质质量分数为5%的NaCl溶液需要加水20gB.气体的溶解度与温度、压强和水的用量有关C.饱和溶...” 主要考查您对溶解
饱和溶液,不饱和溶液
关于溶液的计算
气体溶解度
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶解
- 饱和溶液,不饱和溶液
- 关于溶液的计算
- 气体溶解度
溶解定义:
广义上说,超过两种以上物质混合而成为一个分子状态的均匀相的过程称为溶解。而狭义的溶解指的是一种液体对于固体/液体/或气体产生化学反应使其成为分子状态的均匀相的过程称为溶解。一种物质(溶质)分散于另一种物质(溶剂)中成为溶液的过程。如食盐或蔗糖溶解于水而成水溶液。溶液并不一定为液体,可以是固体、液体、气体。比如均匀的合金和空气都可以称为溶液。当两种物质互溶时,一般把质量大的物质称为溶剂(如有水在其中,一般习惯将水称为溶剂)。
溶解过程:
物质溶解于水,通常经过两个过程:一种是溶质分子(或离子)的扩散过程,这种过程为物理过程,需要吸收热量;另一种是溶质分子(或离子)和溶剂(水)分子作用,形成溶剂(水合)分子(或水合离子)的过程,这种过程是化学过程,放出热量。当放出的热量大于吸收的热量时,溶液温度就会升高,如浓硫酸、氢氧化钠等;当放出的热量小于吸收的热量时,溶液温度就会降低,如硝酸铵等;当放出的热量等于吸收的热量时,溶液温度不变,如盐、蔗糖。
固体、液体及气体溶解的对比分析:
(1)固体溶解
固体溶解时,常需要粉碎,加热,震荡,搅拌等方法加速溶解。

(2)液体溶解
一般液体溶解时,将液体加水搅拌均匀。
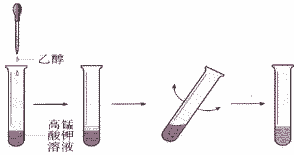
(3)气体溶解
气体溶解时,对于溶解度小的气体要把导管插入水中,极易溶于水的气体,应在导管末端插一倒置的漏斗,漏斗边缘接触水。
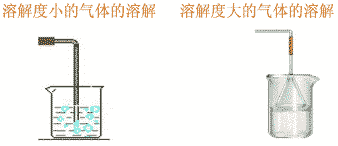
溶解性应用:
1、是指物质在溶剂里溶解能力的大小。
2、溶解性是物理性质,溶解是物理变化。
3、溶解性是由20℃时某物质的溶解度决定的。(固体)
4、利用溶解性可有以下应用:
(1)判断气体收集方法
可溶(易溶)于水的气体不能用排水取气法。
如:CO2而H2,O2溶解性不好,可用排水取气法。
(2)判断混合物分离方法
两种物质在水中溶解性明显不同时,可用过滤法分离。
如:KNO3(易溶)与CaCO3(难溶)可用过滤法分离
而C与MnO2二者均不溶NaClKNO3均易溶,都不能用过滤法分离。
溶解度算法=溶质质量/溶剂质量(通常为水)
单位: g/100g水。
广义上说,超过两种以上物质混合而成为一个分子状态的均匀相的过程称为溶解。而狭义的溶解指的是一种液体对于固体/液体/或气体产生化学反应使其成为分子状态的均匀相的过程称为溶解。一种物质(溶质)分散于另一种物质(溶剂)中成为溶液的过程。如食盐或蔗糖溶解于水而成水溶液。溶液并不一定为液体,可以是固体、液体、气体。比如均匀的合金和空气都可以称为溶液。当两种物质互溶时,一般把质量大的物质称为溶剂(如有水在其中,一般习惯将水称为溶剂)。
溶解过程:
物质溶解于水,通常经过两个过程:一种是溶质分子(或离子)的扩散过程,这种过程为物理过程,需要吸收热量;另一种是溶质分子(或离子)和溶剂(水)分子作用,形成溶剂(水合)分子(或水合离子)的过程,这种过程是化学过程,放出热量。当放出的热量大于吸收的热量时,溶液温度就会升高,如浓硫酸、氢氧化钠等;当放出的热量小于吸收的热量时,溶液温度就会降低,如硝酸铵等;当放出的热量等于吸收的热量时,溶液温度不变,如盐、蔗糖。
固体、液体及气体溶解的对比分析:
(1)固体溶解
固体溶解时,常需要粉碎,加热,震荡,搅拌等方法加速溶解。

(2)液体溶解
一般液体溶解时,将液体加水搅拌均匀。

(3)气体溶解
气体溶解时,对于溶解度小的气体要把导管插入水中,极易溶于水的气体,应在导管末端插一倒置的漏斗,漏斗边缘接触水。

溶解性应用:
1、是指物质在溶剂里溶解能力的大小。
2、溶解性是物理性质,溶解是物理变化。
3、溶解性是由20℃时某物质的溶解度决定的。(固体)
| (20℃) | 难溶(不溶) | 微溶 | 可溶 | 易溶 |
| <0.01g | 0.01g~1g | 1 g~10g | >10g |
4、利用溶解性可有以下应用:
(1)判断气体收集方法
可溶(易溶)于水的气体不能用排水取气法。
如:CO2而H2,O2溶解性不好,可用排水取气法。
(2)判断混合物分离方法
两种物质在水中溶解性明显不同时,可用过滤法分离。
如:KNO3(易溶)与CaCO3(难溶)可用过滤法分离
而C与MnO2二者均不溶NaClKNO3均易溶,都不能用过滤法分离。
溶解度算法=溶质质量/溶剂质量(通常为水)
单位: g/100g水。
饱和溶液和不饱和溶液的概念:
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液 不饱和溶液
不饱和溶液
(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水 不饱和石灰水
不饱和石灰水
概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)
溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液 饱和溶液
饱和溶液
溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)
溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液 不饱和溶液
不饱和溶液
溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
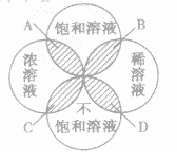 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液
 不饱和溶液
不饱和溶液(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水
 不饱和石灰水
不饱和石灰水概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液
 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液
 饱和溶液
饱和溶液溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液
 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液
 不饱和溶液
不饱和溶液溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
溶质质量分数:
1. 概念:溶液中溶质的质量分数是溶质质量与溶液质量之比。
2. 表达式:
溶质质量分数= =
=
3. 含义:溶质质量分数的含义是指每100份质量的溶液中含有溶质的质份为多少。如100g10%的NaCl溶液中含有10gNaCl.。不要误认为是100g水中含有10gNaCl。
应用溶质质量分数公式的注意事项:
①溶质的质量是指形成溶液的那部分溶质,没有进入溶液的溶质不在考虑范围之内。如在20℃时,100g水中最多能溶解36gNaCl,则20gNaCl放入50g 水中溶解后,溶质的质量只能是18g。
②溶液的质量是该溶液中溶解的全部溶质的质量与溶剂的质量之和(可以是一种或几种溶质)。
③计算时质量单位应统一。
④由于溶液的组成是指溶液中各成分在质量方面的关系,因此,对溶液组成的变化来说,某物质的质量分数只有在不超过其最大溶解范围时才有意义。
例如在20℃时,NaCl溶液中溶质的质量分数最大为26.5%,此时为该温度下氯化钠的饱和溶液,再向溶液中加入溶质也不会再溶解,浓度也不会再增大。因此离开实际去讨论溶质质量分数更大的NaCl溶液是没有意义的。
⑤运用溶质质量分数表示溶液时,必须分清溶质的质量、溶剂的质量和溶液的质量。
a.结晶水合物溶于水时,其溶质指不含结晶水的化合物。如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数= ×100%
×100%
b.当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数= 。
。
c.若两种物质能发生反应,有沉淀或气体生成,此时溶液中的溶质质量分数=
影响溶质质量分数的因素:
(1)影响溶质质量分数的因素是溶质、溶剂的质录,与温度、是否饱和无关。在改变温度的过程中若引起溶液中溶质、溶剂质量改变,溶质的质量分数也会改变,但归根结底,变温时必须考虑溶质、溶剂的质量是否改变。因而,影响溶质的质量分数的因素还是溶质、溶剂的质量。例如:
①将饱和的NaNO3溶液降低温度,由于析出品体,溶液中溶质的质缺减少,溶剂的质量不变,所以溶液中溶质的质量分数变小。
②将饱和的NaNO3溶液升高温度,只是溶液变成了不饱和溶液,溶液中溶质、溶剂的质量不变,因而溶液中溶质的质量分数不变。
(2)不要认为饱和溶液变成不饱和溶液,溶质的质量分数就变小;也不要认为不饱和溶液变成饱和溶液,溶质的质量分数就变大;要具体问题具体分析。
有关溶质质量分数计算的类型
(1)利用公式的基本计算
①已知溶质、溶剂的质量,求溶质的质量分数。
直接利用公式:溶质的质量分数= ×100%
×100%
②已知溶液、溶质的质量分数,求溶质、溶剂的质量。
利用公式:溶质的质量=溶液的质量×溶质的质量分数
溶剂的质量=溶液的质量一溶质的质量
③已知溶质的质量、溶质的质量分数,求溶液的质量。
利用公式:溶液的质量=溶质的质量÷溶质的质量分数
④质量、体积、密度与溶质质量分数的换算
当溶液的量用体积表示时,计算时应首先将溶液的体积换算成质量后再进行相关计算。因为计算溶质的质量分数的公式中各种量都是以质量来表示的,不能以体积的数据来代替。
利用公式:溶液的质量=溶液的体积×溶液的密度
(2)溶液的稀释与浓缩
注意:
a.几种溶液混合,溶液的体积不能简单相加,即V总≠VA+VB
b.混合后溶液的质量、溶质的质量可以相加,即m总=mA+mB
c. 要求混合后溶液的总体积,必须依据公式V=m/ρ,所以要知道混合溶液的密度才能求出总体积。
(3)饱和溶液中溶质质量分数的计算
a. 固体溶解度的计算公式
根据固体溶解度的计算公式[溶解度(S)= ×100g]可推导出:
×100g]可推导出: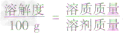 ,
,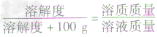
b. 溶解度与溶质质量分数的关系
特殊的溶质质量分数的计算:
(1)结晶水合物溶于水时,其溶质指不含结晶水的化合物。
如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数= ×100%
×100%
(2)溶质只能是已溶解的那一部分,没有溶解的不能做溶质计算
如20℃时,20gNaCl投入到50g中水中(20℃时,NaCl的溶解度为36g)。20℃时50g水最多只能溶解18gNaCl,如溶质的质量为18g,而不是20g,所以该NaCl溶液的质量分数=18g/(50g+18g)×100%=26.5%。
(3)当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数= 。
。
(4)某混合物溶于水,要计算某一溶质的质量分数,溶液的质量包括混合物与水的质量
如5gNaCl和1gKNO3的混合物溶于100g水,计算NaCl的溶质质量分数:
ω(NaCl)=5g/(5g+1g+100g)×100%=4.7%。
(5)利用元素的质量分数进行计算
溶液中溶质的质量分数与溶质中某元素的质量分数之间有着联系。溶液的溶质质量分数×溶质中某元素的质量分数=溶液中某元素的质量分数。
溶质质量分数的不变规律:
(1)从一瓶溶液中不论取出多少溶液,取出溶液及剩余溶液的溶质质量分数与原来溶液中溶质质量分数相同。
(2)溶质、溶质质量分数均相同的两种溶液混合,所得溶液的质量分数保持不变。
(3)一定温度时,向某饱和溶液中加入该溶质,所得溶液的溶质质量分数保持不变。
(4)一定温度时,对某饱和溶液恒温蒸发溶剂,所得溶液的溶质质量分数保持不变。
(5)对于溶解度随温度升高而增大的物质来说,将其饱和溶液(底部没有固体时)升高温度,所得溶液的溶质质量分数保持不变。而对于溶解度随温度升高而减小的物质(熟石灰)来说,降低温度,所得溶液的溶质质量分数保持不变。
1. 概念:溶液中溶质的质量分数是溶质质量与溶液质量之比。
2. 表达式:
溶质质量分数=
 =
=
3. 含义:溶质质量分数的含义是指每100份质量的溶液中含有溶质的质份为多少。如100g10%的NaCl溶液中含有10gNaCl.。不要误认为是100g水中含有10gNaCl。
应用溶质质量分数公式的注意事项:
①溶质的质量是指形成溶液的那部分溶质,没有进入溶液的溶质不在考虑范围之内。如在20℃时,100g水中最多能溶解36gNaCl,则20gNaCl放入50g 水中溶解后,溶质的质量只能是18g。
②溶液的质量是该溶液中溶解的全部溶质的质量与溶剂的质量之和(可以是一种或几种溶质)。
③计算时质量单位应统一。
④由于溶液的组成是指溶液中各成分在质量方面的关系,因此,对溶液组成的变化来说,某物质的质量分数只有在不超过其最大溶解范围时才有意义。
例如在20℃时,NaCl溶液中溶质的质量分数最大为26.5%,此时为该温度下氯化钠的饱和溶液,再向溶液中加入溶质也不会再溶解,浓度也不会再增大。因此离开实际去讨论溶质质量分数更大的NaCl溶液是没有意义的。
⑤运用溶质质量分数表示溶液时,必须分清溶质的质量、溶剂的质量和溶液的质量。
a.结晶水合物溶于水时,其溶质指不含结晶水的化合物。如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数=
 ×100%
×100%b.当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数=
 。
。c.若两种物质能发生反应,有沉淀或气体生成,此时溶液中的溶质质量分数=

影响溶质质量分数的因素:
(1)影响溶质质量分数的因素是溶质、溶剂的质录,与温度、是否饱和无关。在改变温度的过程中若引起溶液中溶质、溶剂质量改变,溶质的质量分数也会改变,但归根结底,变温时必须考虑溶质、溶剂的质量是否改变。因而,影响溶质的质量分数的因素还是溶质、溶剂的质量。例如:
①将饱和的NaNO3溶液降低温度,由于析出品体,溶液中溶质的质缺减少,溶剂的质量不变,所以溶液中溶质的质量分数变小。
②将饱和的NaNO3溶液升高温度,只是溶液变成了不饱和溶液,溶液中溶质、溶剂的质量不变,因而溶液中溶质的质量分数不变。
(2)不要认为饱和溶液变成不饱和溶液,溶质的质量分数就变小;也不要认为不饱和溶液变成饱和溶液,溶质的质量分数就变大;要具体问题具体分析。
有关溶质质量分数计算的类型
(1)利用公式的基本计算
①已知溶质、溶剂的质量,求溶质的质量分数。
直接利用公式:溶质的质量分数=
 ×100%
×100% ②已知溶液、溶质的质量分数,求溶质、溶剂的质量。
利用公式:溶质的质量=溶液的质量×溶质的质量分数
溶剂的质量=溶液的质量一溶质的质量
③已知溶质的质量、溶质的质量分数,求溶液的质量。
利用公式:溶液的质量=溶质的质量÷溶质的质量分数
④质量、体积、密度与溶质质量分数的换算
当溶液的量用体积表示时,计算时应首先将溶液的体积换算成质量后再进行相关计算。因为计算溶质的质量分数的公式中各种量都是以质量来表示的,不能以体积的数据来代替。
利用公式:溶液的质量=溶液的体积×溶液的密度
(2)溶液的稀释与浓缩
| 方法 | 计算依据 | 计算公式 | |
| 溶液的稀释 | ①加水稀释 ②加稀溶液稀释 |
①加水稀释前后,溶液中溶质的质量不变 ②用稀溶液稀释浓溶液时。稀溶液中溶质的质量与浓溶液中溶质的质量之和等于混合后溶液中溶质的质量 |
加水稀释:稀释前后溶液中溶质的质量不变 m浓×ω浓%=(m浓+m水)×ω稀% |
| 溶液的浓缩 | ①添加溶质 ②蒸发溶剂 ③加入浓溶液 | ①原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中的溶质质量 ②蒸发溶剂前后溶液中溶质的质量不变(没有溶质析出) ③原溶液中的溶质与后加入浓溶液中的溶质质量之和等于混合后溶液中的溶质质量 |
蒸发浓缩:浓缩前后溶液中溶质的质量不变(m稀-m水)×ω浓%=m稀×ω稀% |
a.几种溶液混合,溶液的体积不能简单相加,即V总≠VA+VB
b.混合后溶液的质量、溶质的质量可以相加,即m总=mA+mB
c. 要求混合后溶液的总体积,必须依据公式V=m/ρ,所以要知道混合溶液的密度才能求出总体积。
(3)饱和溶液中溶质质量分数的计算
a. 固体溶解度的计算公式
根据固体溶解度的计算公式[溶解度(S)=
 ×100g]可推导出:
×100g]可推导出: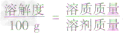 ,
,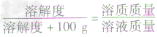
b. 溶解度与溶质质量分数的关系
| 溶解度 | 溶质质量分数 | |
| 意义 | 物质溶解性的量度,受外界温度的影响 | 表示溶液中溶质质量的多少,不受外界条件影响 |
| 容积要求 | 100g | 无要求 |
| 温度要求 | 与温度有关 | 一般与温度无关 |
| 溶液是否饱和 | 一定达到饱和 | 不一定饱和 |
| 计算公式 |  ×100g ×100g |
 |
| 单位 | 克 | 无单位 |
| 联系 | 饱和溶液中溶质的质量分数= | |
特殊的溶质质量分数的计算:
(1)结晶水合物溶于水时,其溶质指不含结晶水的化合物。
如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数=
 ×100%
×100%(2)溶质只能是已溶解的那一部分,没有溶解的不能做溶质计算
如20℃时,20gNaCl投入到50g中水中(20℃时,NaCl的溶解度为36g)。20℃时50g水最多只能溶解18gNaCl,如溶质的质量为18g,而不是20g,所以该NaCl溶液的质量分数=18g/(50g+18g)×100%=26.5%。
(3)当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数=
 。
。(4)某混合物溶于水,要计算某一溶质的质量分数,溶液的质量包括混合物与水的质量
如5gNaCl和1gKNO3的混合物溶于100g水,计算NaCl的溶质质量分数:
ω(NaCl)=5g/(5g+1g+100g)×100%=4.7%。
(5)利用元素的质量分数进行计算
溶液中溶质的质量分数与溶质中某元素的质量分数之间有着联系。溶液的溶质质量分数×溶质中某元素的质量分数=溶液中某元素的质量分数。
溶质质量分数的不变规律:
(1)从一瓶溶液中不论取出多少溶液,取出溶液及剩余溶液的溶质质量分数与原来溶液中溶质质量分数相同。
(2)溶质、溶质质量分数均相同的两种溶液混合,所得溶液的质量分数保持不变。
(3)一定温度时,向某饱和溶液中加入该溶质,所得溶液的溶质质量分数保持不变。
(4)一定温度时,对某饱和溶液恒温蒸发溶剂,所得溶液的溶质质量分数保持不变。
(5)对于溶解度随温度升高而增大的物质来说,将其饱和溶液(底部没有固体时)升高温度,所得溶液的溶质质量分数保持不变。而对于溶解度随温度升高而减小的物质(熟石灰)来说,降低温度,所得溶液的溶质质量分数保持不变。
概念:
气体的溶解度是指在压强为101kPa和一定温度时,气体溶解在3体积水里达到饱和状态时的气体体积。如氮气在压强为101kPa和温度为0℃ 时,1体积水里最多能溶解0.024体积氮气,则在0℃ 时,氮气的溶解度为0.024。
影响气体溶解度的因素:
①压强:气体的溶解度随着压强的增大而增大,随若压强的减小而减小。
②温度:气体的溶解度随着温度的升高而减小,随着温度的降低而增大。
应用气体溶解度的知识来解释的现象:
①夏天打开汽水瓶盖时,压强减小,气体的溶解度减小,会有大量气泡冒出。
②喝汽水后会打隔,是因为汽水到胃中后,温度升高、气体的溶解度减小。
③养鱼池中放几个水泵,把水喷向空中,增大与氧气的接触面积,增加水中氧气的溶解量。
④不能用煮拂后的凉开水养鱼,因为温度升高,水巾溶解的氧气减少,因而凉开水中几乎不含氧气。
气体的溶解度是指在压强为101kPa和一定温度时,气体溶解在3体积水里达到饱和状态时的气体体积。如氮气在压强为101kPa和温度为0℃ 时,1体积水里最多能溶解0.024体积氮气,则在0℃ 时,氮气的溶解度为0.024。
影响气体溶解度的因素:
①压强:气体的溶解度随着压强的增大而增大,随若压强的减小而减小。
②温度:气体的溶解度随着温度的升高而减小,随着温度的降低而增大。
应用气体溶解度的知识来解释的现象:
①夏天打开汽水瓶盖时,压强减小,气体的溶解度减小,会有大量气泡冒出。
②喝汽水后会打隔,是因为汽水到胃中后,温度升高、气体的溶解度减小。
③养鱼池中放几个水泵,把水喷向空中,增大与氧气的接触面积,增加水中氧气的溶解量。
④不能用煮拂后的凉开水养鱼,因为温度升高,水巾溶解的氧气减少,因而凉开水中几乎不含氧气。
发现相似题
与“下列说法正确的是( )A.用50g溶质质量分数为10%的NaCl溶液...”考查相似的试题有:
- 下列叙述正确的是( )A.用托盘天平称取5.26 g氧化铜B.用药匙搅拌加速氢氧化钠溶解C.用l00 mL量筒量取98.98 mL水D.用镊子...
- 水在实验室和日常生产生活中有很多用途.(1)在天然水中有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度...
- 请你根据如图甲、乙两种物质的溶解度曲线回答下列问题:(1)甲的溶解度比乙大,此结论是否正确______.(2)图中A点表示的意...
- 请根据下列实验回答问题:(已知水的密度为1g/cm3)步骤实验操作实验结果1取100mL水,加入20g硝酸钾,搅拌,恢复至20℃全部溶...
- 定量研究是科学研究的重要方法之一,利用它能解决许多生产生活中的实际问题(1)将20g质量分数为4%的氢氧化钠溶液与7.3g稀盐酸...
- 将溶质质量分数为10%的NaCl溶液40g,变成溶质质量分数为20%的NaCl溶液,可采取的方法是:①蒸发18g水;②加4g溶质;③蒸发20g水...
- 把20g不纯的碳酸钾固体(其中杂质不溶于水)放入86.2g水中,充分搅拌,使固体中的碳酸钾完全溶解,过滤,取10g滤液,向其中滴...
- 31、A、B、C是三种物质的溶解度曲线.请回答:(1)t1℃时,三种物质的溶解度的大小顺序是______M点表示的意义是:______(2)...
- 下图为A、B两种固体物质的溶解度曲线。(1)在 ℃时,A、B两种物质的溶解度相等。(2)t2℃时,100g水中溶解 gA物质恰好饱和,...
- 右图是NaCl、MgSO4的溶解度曲线。请回答下列问题:加热t2℃的MgSO4饱和溶液,会看到的现象是 ;将t1℃时MgSO4的饱和溶液升温至t...