本试题 “如图所示的是电解水实验装置.通电一段时间后,在两个试管中分别收集到气体a和气体b.请回答:(1)电解水时,将______转化为化学能;(2)气体a为______;(...” 主要考查您对氢气的制取和收集
电解水实验
化学反应中的能量变化
氢气的检验和验满
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氢气的制取和收集
- 电解水实验
- 化学反应中的能量变化
- 氢气的检验和验满
实验室里通常用稀硫酸跟金属锌起反应来制取氢气,也可以用盐酸代替硫酸,用镁或铁代替锌来制取氢气。
氢气的实验室制法:
| 化学药品 | 锌粒和稀硫酸 |
| 反应原理 | Zn + H2SO4== ZnSO4+ H2↑ |
| 发生装置 | 反应物状态为固态和液态,反应条件为室温,可选择实验室制CO2的反应装置(或用过氧化氢溶液制氧气的反应装置)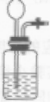 |
| 收集装置 | 向下排空气法或排水法  |
| 实验步骤 | ①检验装置的气密性 ②装锌粒(注意将试管横放,把锌粒放入试管口,再慢慢竖起) ③把试管固定在铁架台上 ④加入稀硫酸 ⑤收集气体 |
| 注意事项 | ①不能用浓H2SO4代替稀H2SO4,浓H2SO4具有强氧化性 ②不能用金属活动性顺序表中排在氢后面的金属,如铜,也不能用排在氢前的金属,如钠,一般常用Zn、Al、Fe、Mg等。 ③长颈漏斗末端应在液而以下,防止氢气从长颈漏斗逸出 |
氢气的工业制法:
| 制取方法 | 原理 | 优缺点 |
| 电解水 | 2H2O 2H2↑+O2 2H2↑+O2 |
优点:得到氢气纯度高 缺点:耗能高 |
| 水煤气 | C+H2O(g) CO+H2 CO+H2 |
优点:成本低 缺点:需要设备多(需要除去CO中的杂质) |
| 天然气 | CH4 C+2H2 C+2H2 |
优点:原料丰富 缺点:氢气纯度低 |
| 电解饱和食盐水 | 2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 2NaOH+H2↑+Cl2↑ |
优点:是氯碱化工的副产品 缺点:纯度低 |
| 理想模式:利用太阳能、高效催化剂分解水 | 2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
优点:不耗费电能、热能,环保 缺点:人类未能寻找到高效催化剂,还未能实际应用 |
电解原理
电解就是将两根金属或碳棒(即电极)放在要分解的物质(电解质)中,然后接上电源,使电流通过液体。化合物的阳离子移到带负电的电极(阴极),阴离子移到带正电的电极(阳极),化合物分为二极。
电解过程
用电使化合物分解的过程就叫电解过程。
水(H2O)被电解生成电解水。电流通过水(H2O)时,氢气在阴极形成,氧气则在阳极形成。带正电荷的离子向阴极移动,溶于水中的矿物质钙、镁、钾、钠……带正电荷的离子,便在阴极形成,就是我们所喝的碱性水;而带负电的离子,在阴极生成。
电解水实验:
1.实验装置图:
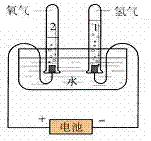
2.表达式:
水 氢气+氧气
氢气+氧气
2H2O 2H2↑+O2↑
2H2↑+O2↑
3.实验现象:
(1)通电后两电极上都有气泡产生;
(2)与电源正极相连接的一端产生的气体比连接负极一端产生的气体少,
接负极一端玻璃管中气体的体积是接正极一端玻璃管内气体体积的2倍。
4.产物检验
(1)正极一端的气体能使带火星的木条复燃,证明气体是氧气。
(2)负极一端的气体能燃烧,并看到微弱的淡蓝色火焰(或听到爆鸣声),
证明气体是氢气。
5.实验结论:
(1)水是由氢元素和氧元素组成的。
(2)1个水分子由2个氢原子和1个氧原子构成。
(3)化学变化中,分子可以再分,原子不可以再分。
6.注意事项:
(1)实验前在水中加入少量的氢氧化钠或者稀硫酸,可增强水的导电性,
加快反应速率。
(2)实验开始时产生的氧气和氢气的体积会小于1:2,是因为氢气难溶于水,
氧气不易溶于水,开始产生的氧气有一部分溶于水,实验时间越长,
其比值越接近1:2。
电解水记忆口诀:
水中通入直流电,正氧负氢会出现;氢二氧一体积比,任何时候都不变。
电解就是将两根金属或碳棒(即电极)放在要分解的物质(电解质)中,然后接上电源,使电流通过液体。化合物的阳离子移到带负电的电极(阴极),阴离子移到带正电的电极(阳极),化合物分为二极。
电解过程
用电使化合物分解的过程就叫电解过程。
水(H2O)被电解生成电解水。电流通过水(H2O)时,氢气在阴极形成,氧气则在阳极形成。带正电荷的离子向阴极移动,溶于水中的矿物质钙、镁、钾、钠……带正电荷的离子,便在阴极形成,就是我们所喝的碱性水;而带负电的离子,在阴极生成。
电解水实验:
1.实验装置图:

2.表达式:
水
 氢气+氧气
氢气+氧气2H2O
 2H2↑+O2↑
2H2↑+O2↑3.实验现象:
(1)通电后两电极上都有气泡产生;
(2)与电源正极相连接的一端产生的气体比连接负极一端产生的气体少,
接负极一端玻璃管中气体的体积是接正极一端玻璃管内气体体积的2倍。
4.产物检验
(1)正极一端的气体能使带火星的木条复燃,证明气体是氧气。
(2)负极一端的气体能燃烧,并看到微弱的淡蓝色火焰(或听到爆鸣声),
证明气体是氢气。
5.实验结论:
(1)水是由氢元素和氧元素组成的。
(2)1个水分子由2个氢原子和1个氧原子构成。
(3)化学变化中,分子可以再分,原子不可以再分。
6.注意事项:
(1)实验前在水中加入少量的氢氧化钠或者稀硫酸,可增强水的导电性,
加快反应速率。
(2)实验开始时产生的氧气和氢气的体积会小于1:2,是因为氢气难溶于水,
氧气不易溶于水,开始产生的氧气有一部分溶于水,实验时间越长,
其比值越接近1:2。
电解水记忆口诀:
水中通入直流电,正氧负氢会出现;氢二氧一体积比,任何时候都不变。
定义:
化学反应不仅有物质的变化,还伴随着能量的变化,通常表现为热量变化。有些化学反应会放出热量(称为放热反应),如燃烧、镁和盐酸反应等;也有些反应会吸收热量(称为吸热反应),如碳与二氧化碳反应(C+CO2 2CO)。
2CO)。
常见的吸热反应:
化学上把最终表现为吸收热量的反应叫吸热反应,初中化学所涉及的吸热反应主要有以下几种:
①C+CO2 2CO
2CO
C+2CuO 2Cu+CO2↑
2Cu+CO2↑
CaCO3 CaO+CO2↑
CaO+CO2↑
3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
可见,一般反应条件为高温的反应是吸热反应。
常见的放热反应:
化学上把最终表现为放出热量的反应叫放热反应,初中化学所涉及的放热反应主要有以下几种:
①燃烧:所有燃烧均会放热,如CH4+2O2 CO2+2H2O,H2+Cl2
CO2+2H2O,H2+Cl2 2HCl;
2HCl;
②酸碱中和:酸与碱反应生成盐和水,同时放出热量,如H2SO4+2NaOH==Na2SO4+2H2O
③活拨金属与酸发生置换反应生成H2,同时放出热量,如Mg+2HCl==MgCl2+H2↑,Zn+H2SO4== ZnSO4+H2↑。
④缓慢氧化也是放热反应,如铁生锈、食物腐烂过程中均放出热量。
⑤其他:如双氧水分解是放热反应
人类生活对能量的利用:
①生活燃料的利用:做饭、取暖等;
②利用燃料烧烧产生的能量:发电、制陶瓷、冶炼金属和发射火箭;
③利用爆炸产生的巨大能量:开山炸石、拆除违规建筑;
④食物在体内发生缓慢氧化放出热量,维持体温
化学反应不仅有物质的变化,还伴随着能量的变化,通常表现为热量变化。有些化学反应会放出热量(称为放热反应),如燃烧、镁和盐酸反应等;也有些反应会吸收热量(称为吸热反应),如碳与二氧化碳反应(C+CO2
 2CO)。
2CO)。 常见的吸热反应:
化学上把最终表现为吸收热量的反应叫吸热反应,初中化学所涉及的吸热反应主要有以下几种:
①C+CO2
 2CO
2CO C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ CaCO3
 CaO+CO2↑
CaO+CO2↑ 3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2 可见,一般反应条件为高温的反应是吸热反应。
常见的放热反应:
化学上把最终表现为放出热量的反应叫放热反应,初中化学所涉及的放热反应主要有以下几种:
①燃烧:所有燃烧均会放热,如CH4+2O2
 CO2+2H2O,H2+Cl2
CO2+2H2O,H2+Cl2 2HCl;
2HCl;②酸碱中和:酸与碱反应生成盐和水,同时放出热量,如H2SO4+2NaOH==Na2SO4+2H2O
③活拨金属与酸发生置换反应生成H2,同时放出热量,如Mg+2HCl==MgCl2+H2↑,Zn+H2SO4== ZnSO4+H2↑。
④缓慢氧化也是放热反应,如铁生锈、食物腐烂过程中均放出热量。
⑤其他:如双氧水分解是放热反应
人类生活对能量的利用:
①生活燃料的利用:做饭、取暖等;
②利用燃料烧烧产生的能量:发电、制陶瓷、冶炼金属和发射火箭;
③利用爆炸产生的巨大能量:开山炸石、拆除违规建筑;
④食物在体内发生缓慢氧化放出热量,维持体温
氢气检验和验满方法:
1.检验:点燃待检测的气体,在火焰上方罩一个干燥的烧杯有水珠出现,滴入澄清石灰水
不变浑浊,则证明有氢气的存在
2.验满:一般使用排水法收集比较纯净的氢气,可以根据液面的高度判断。
向下排空气法:把带火星的木条放到瓶口,若有轻微的爆鸣声,说明氢气已满。
1.检验:点燃待检测的气体,在火焰上方罩一个干燥的烧杯有水珠出现,滴入澄清石灰水
不变浑浊,则证明有氢气的存在
2.验满:一般使用排水法收集比较纯净的氢气,可以根据液面的高度判断。
向下排空气法:把带火星的木条放到瓶口,若有轻微的爆鸣声,说明氢气已满。
发现相似题
与“如图所示的是电解水实验装置.通电一段时间后,在两个试管中...”考查相似的试题有:
- (7分)下图是实验室常用的装置。请据图回答:(1)写出仪器①的名称 。(2)用高锰酸钾制取氧气的发生装置是 (填序号),反...
- 如图是实验室常用的装置,请据图回答:(1)写出仪器①的名称 。在实验室收集二氧化碳气体一般只用D装置,由此推测二氧化碳气...
- (4分)实验室常用下列装置制取气体,请你根据所学知识回答下列问题。(1)甲同学用A作为制氧气的发生装置,乙同学用B作为制氧...
- A~J分别为九年级化学学过的不同纯净物,它们存在下图所示的转化关系.已知A为铁锈的主要成分,E在常温下为无色液体,H的溶液...
- 我们做实验就是要根据实验现象进行合理推理,最终得出实验结论.如图是电解水的实验,我们做该实验目的是______.该实验有如...
- 水在通电时生成氢气和氧气,在此反应中,水、氢气和氧气的质量比为A.1:2:3B.2:1:3C.1:8:9D.9:1:8
- 请根据电解水实验回答下列问题:(l)通电后电极上出现气泡,负极产生的气体是______;(2)实验时常在水中加入硫酸或氢氧化...
- 在某次电解水的实验中加入了少量的NaOH溶液,测得分别与电源正、负两极相连的阳、阴两极上产生的气体体积,实验数据如下表所...
- 水是生命之源,我们应该了解水、爱护水资源。下列说法错误的是A.为使水中的悬浮杂质沉降,可在水中加入适量的明矾B.自来水...
- 下列说法不正确的是[ ]A.干电池工作的时候释放电能B. 面粉、蔗糖灼烧后都变成炭黑,说明它们是同种物质C.绿色植物吸收太阳能...