本试题 “下列物质与其用途相符合的是[ ]①N2-保护气 ②SiO2-光导纤维 ③AgI-人工降雨 ④碘-预防甲状腺肿大 ⑤Al2O3-耐火材料 ⑥NaClO-消毒剂A.②③④⑤⑥B.①②③④⑤C.②③④⑤D.全部” 主要考查您对61. 其它金属及化合物(锌、锰、钙、金等)
氮气
生活中的元素(常量元素、微量元素)
复合材料
塑料、纤维、橡胶
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 61. 其它金属及化合物(锌、锰、钙、金等)
- 氮气
- 生活中的元素(常量元素、微量元素)
- 复合材料
- 塑料、纤维、橡胶
锌的单质及化合物:
①单质锌:
物理性质:锌化学符号是Zn,它的原子序数是30。锌是一种蓝白色金属。密度为7.14克/立方厘米,熔点为419.5℃。在室温下,性较脆;100~150℃时,变软;超过200℃后,又变脆。锌的化学性质活泼,在常温下的空气中,表面生成一层薄而致密的碱式碳酸锌膜,可阻止进一步氧化。当温度达到225℃后,锌氧化激烈。燃烧时,发出蓝绿色火焰。锌易溶于酸,也易从溶液中置换金、银、铜等。锌的氧化膜熔点高,但金属锌熔点却很低,所以在酒精灯上加热锌片,锌片熔化变软,却不落下,正是因为氧化膜的作用。锌是第四常见的金属,仅次于铁、铝及铜。
化学性质:2Zn+O2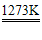 2ZnO Zn+X2
2ZnO Zn+X2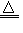 ZnX2(X=F、Cl、Br、I) 3Zn+2P
ZnX2(X=F、Cl、Br、I) 3Zn+2P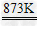 Zn3P2 Zn+S
Zn3P2 Zn+S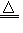 ZnS
ZnS
②氢氧化锌 Zn2++2NaOH==Zn(OH)2+2Na+ Zn(OH)2+2H+==Zn2++H2O Zn(OH)2+2OH-==[Zn(OH)4]2- Zn(OH)2+4NH3+2NH4+==[Zn(NH3)4]2++2H2O Zn(OH)2==ZnO+H2O
[Zn(NH3)4]2++2OH-==Zn(OH)2+4NH3↑
③氯化锌 ZnO+2HCl ZnCl2+H2O ZnCl2+2H2O===Zn(OH)Cl+2HCl ZnCl2+H2O=H2[ZnCl2(OH)2] FeO+H2[ZnCl2(OH)2]==Fe[ZnCl2(OH)]2+H2O Zn+CuCl2=ZnCl2+Cu
ZnCl2+H2O ZnCl2+2H2O===Zn(OH)Cl+2HCl ZnCl2+H2O=H2[ZnCl2(OH)2] FeO+H2[ZnCl2(OH)2]==Fe[ZnCl2(OH)]2+H2O Zn+CuCl2=ZnCl2+Cu
④硫化锌 2ZnO+2S==2ZnS+O2 Zn2++(NH4)2S==ZnS+2NH4+ ZnSO4+BaS==ZnS+BaSO4 Zn2++H2S==ZnS+2H+
⑤锌的配合物(a)[Zn(NH3)4]2+、(b)[Zn(CN)4]2-
钙的单质及化合物:
①单质钙:活泼金属
②氧化钙:俗称生石灰,白色块状固体;与水反应放出大量热,块状固体变成粉末状CaO+H2O==Ca(OH)2
③氢氧化钙:俗称熟石灰,常用来检验二氧化碳气体Ca(OH)2+CO2==CaCO3↓+H2O
④碳酸钙:俗称石灰石,白色固体,不溶于水,常用的建筑材料,实验室常用其和稀盐酸反应制取二氧化碳CaCO3+2HCl==CaCl2+CO2↑+H2O
银的单质及化合物:
①物理性质:银是一种化学元素,化学符号Ag,原子序数47,是一种银白色的贵金属。银性质稳定,质软富有延展性。导热,导电率高,不易受酸碱的腐蚀
②化学性质:银的特征氧化数为+1,其化学性质比铜差,常温下,甚至加热时也不与水和空气中的氧作用。但当空气中含有硫化氢时,银的表面会失去银白色的光泽,这是因为银和空气中的H2S化合成黑色Ag2S的缘故。其化学反应方程式为: 4Ag+H2S+O2=2Ag2S+2H2O
银不能与稀盐酸或稀硫酸反应放出氢气,但银能溶解在硝酸或热的浓硫酸中:2Ag+2H2SO4(浓) Ag2SO4+SO2↑+2H2O
Ag2SO4+SO2↑+2H2O
银在常温下与卤素反应很慢,在加热的条件下即可生成卤化物:
2Ag+F2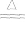 2AgF暗棕色
2AgF暗棕色
2Ag+Cl2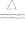 2AgCl白色
2AgCl白色
2Ag+Br2 2AgBr淡黄色
2AgBr淡黄色
2Ag+I2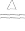 2AgI黄色
2AgI黄色
银对硫有很强的亲合势,加热时可以与硫直接化合成Ag2S:2Ag+S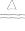 Ag2S
Ag2S
银易溶于硝酸和热的浓硫酸,微溶于热的稀硫酸而不溶于冷的稀硫酸。盐酸和王水只能使银表面发生氯化,而生成氯化银薄膜。
银具有很好的耐碱性能,不与碱金属氢氧化物和碱金属碳酸盐发生作用。
氮元素在自然界中的存在形式:
既有游离态又有化合态。空气中含N278%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素
氮气的物理性质和化学性质:
(1)物理性质:纯净的氮气是无色气体,密度比空气略小,氮气在水中的溶解度很小,在常压下101kPa,-195.8℃氮气变成无色液体,-209.9℃变成雪花状固体。氮气的分子结构:氮分子(N2)的电子式为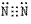 ,结构式为N≡N,由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
,结构式为N≡N,由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
(2)化学性质:氮分子化合价为0价,既可以升高也可以降低,说明氮气既有氧化性又有还原性。
①N2与H2化合生成NH3: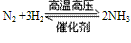
说明:该反应是一个可逆反应,是工业合成氨的原理。
②N2与金属反应(Mg Ca Sr Ba)反应: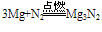
③N2与O2化合生成NO: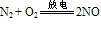
说明:在闪电或行驶的汽车引擎中会发生以上反应。
氮气的用途:
①合成氨,制硝酸;
②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;
⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;
④保存粮食、水果等食品,以防止腐烂;
⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;
⑥利用液氮制造低温环境,使某些超导材料获得超导性能。
常量元素人体中含量较多的元素有11种,它们约占人体质量的99.95%。在人体中含量超过0.01%的元素,称为常量元素。
①人体中的常量元素
| 元素名称 | 元素符号 | 质量分数% |
| 氧 | O | 65.0 |
| 碳 | C | 18.0 |
| 氢 | H | 10.0 |
| 氮 | N | 3.0 |
| 钙 | Ca | 2.0 |
| 磷 | P | 1.0 |
| 钾 | K | 0.35 |
| 硫 | S | 0.25 |
| 钠 | Na | 0.15 |
| 氯 | Cl | 0.15 |
| 镁 | Mg | 0.05 |
②一些常量元素在人体中的作用及每天适宜摄入量
| 钙 | 使骨骼和牙街具有坚硬的结构支架 | 800—1200mg | 缺钙主要影响骨骼的发育和结构,临床症状表现为青少年的佝偻病和成年人的骨质软化症及老年人的骨质疏松症。钙是无毒的元素,但摄入过量会导致高血钙,从而引起消化系统、泌尿系统等的疾病 | 海产品、豆类、奶类、各种绿叶蔬菜等 | 其中99%存在于骨骼和牙齿中,主要以羟基磷酸钙 [Ca10(PO4)6(OH)2晶体的形式存在 |
| 钠 | 细胞外液和细胞内液中的Na+和K+各自保持一定的浓度,维持人体内的水分和体液恒定的pH | 2000—2500mg | 缺钠会引起肌肉痉挛、头痛等;过量会引起水肿、高血压、贫血等 | 食盐 | 其中一半以Na+的形式存在于细胞外液中 |
| 钾 | 1850—5600mg | 缺钾会引起肌肉不发达、心律小齐等;过量会导致恶心、腹泻等 | 香蕉、柑橘、橙子、山楂、蘑菇、豆炎及其制品等 | 主要以K+的形式萍在干细胞内液中 | |
| 镁 | 促进骨骼发育、细胞遗传物质合成等 | 300—400mg | 缺镁会引起肌肉不发达、抽搐、痉挛、心律不齐等;过量会引起神经系统紊乱、肾病等 | 坚果、大豆、牛奶等 | 70%的镁以磷酸盐和碳酸盐形式参与骨骼和牙齿的组成,25%的镁存在于软组织中 |
微量元素:
在人体中含量在0.01%以下的元素。
①一些人体必需的微量元素
| 元素名称 | 元素符号 |
| 铁 | Fe |
| 钴 | Co |
| 铜 | Cu |
| 锌 | Zn |
| 铬 | Cr |
| 锰 | Mn |
| 钼 | Mo |
| 氟 | F |
| 碘 | I |
| 硒 | Se |
②一些必需微量元素对人体的作用及14—18岁人群每天的适宜摄入量
| 元素 | 人体内的含量 | 对人体的作用 | 适宜摄入量(每天) | 摄入量过高,过低对人体健康的影响 |
| 铁 | 4—5g | 是血红蛋白的成分,能帮助氧气的运输 | 20—50mg | 缺铁会引起贫血 |
| 锌 | 2.5g | 影响人体发育 | 15.5—19mg | 缺锌会引起食欲不振,生长迟缓,发育不良 |
| 硒 | 14—21mg | 有防癌、抗癌作用 | 50μg | 缺硒可能引起表皮角质化和癌症。如摄入量过高,会使人中毒 |
| 碘 | 25—50mg | 是甲状腺激素的重要成分 | 150μg | 缺碘会引起甲状腺肿大,幼儿缺碘会影响生长发育,造成思维迟钝。过量也会引起甲状腺肿大 |
| 氟 | 2.6g | 能防治龋齿 | 1.5mg | 缺氟易产生龋齿,过量会引起氟斑牙和氟骨病 |
复合材料:
是由两种或两种以上不同性质的材料,通过物理或化学的方法,在宏观上组成具有新性能的材料。
形形色色的复合材料:
(1)生产、生活中常用的复合材料
| 复合材料 | 玻璃钢 | 碳纤维增强复合材料 | |
| 组成 | 基体 | 合成树脂 | 合成树脂 |
| 增强体 | 玻璃纤维 | 碳纤维 | |
| 特性 | 密度小,质量轻,耐水,耐磨,耐撞,耐腐蚀,良好的绝缘性和机械加工性能 | 韧性好、强度高、质量轻 | |
| 合成方法 | 把玻璃纤维制成纱或织物或切成短纤维加到合成树脂中形成的 | 合成树脂中加入碳纤维而形成 | |
| 用途 | 大量用于制造游乐车、水上滑梯、运输罐、电话亭、餐桌椅、地下废水管道等 | 高尔夫球杆、网球拍、羽毛球拍、钓鱼竿、赛车、滑雪板和冲浪板等体育用品 | |
| 材料名称 | 基体 | 增强体 | 主要优点 | 主要用途 |
| 碳纤维增强金属基复合材料 | 金属 | 碳纤维 | 耐高温,强度高,导电、导热性好,不吸湿,不易老化等 | 飞机、火箭的机冀和机身,导弹的壳体、尾翼 |
| 隔热陶瓷瓦(纤维增强陶瓷) | 陶瓷 | 碳纤维 | 耐高温、有韧性 | 航天飞机机身 |
无机非金属材料、金属材料、复合材料的比较:
无机非金属材料、金属材料、复合材料是三种类型的材料,各自具有其独特的性能。
| 无机非金属材料 | 金属材料 | 复合材料 | |
| 制法 | 传统无机非金属材料是 以含硅物质为原料经高 温烧制而成的 |
(1)纯金属材料可由金属单质经 过形状改变或表面处理而成的 (2)合金是由两种或两种以上的 金属(或金属跟非金属)熔合而成的 |
将两种或两种以上性质不 同的材料经特殊加工而制 成的材料,由基体和增强体组成 |
| 性能 | (1)传统无机非金属材料大多 具有稳定性强、硬度大、熔点 高、难溶于水、绝缘、耐腐蚀 等特点,但质脆,抗冲击性差 (2)新型无机非金属材料能承受 高温,高强度;具有电学特性、 光学特性、生物功能等特性 |
(1)纯金属具有良好的可塑性,较好的导电性和导热性,抗腐蚀性能差 (2)合金具有良好的物理、化学或机械性能,在许多方面优于其成分金属 |
既保持了原材料的特点,又使各组分之间协同作用,其性质优于原材料。不同原材料常表现出不同的性能 |
| 实例 | (1)传统无机非金属材料主要有玻璃、水泥、陶瓷等 (2)新型无机非金属材料包括光导纤维、高温结构陶瓷、生物陶瓷、压电陶瓷等 |
(1)金、银、铜、钛等 (2)铝合金、钢铁、不锈钢等 |
玻璃钢、碳纤维增强复合材料、纤维增强陶瓷等 |
复合材料的组成:

复合材料的分类:
(1)
(2)
合成材料:
又称人造材料,是人为地把不同物质经化学方法或聚合作用加工而成的材料,其特质与原料不同,如塑料、玻璃、钢铁等。三大合成材料:塑料、合成纤维、合成橡胶
塑料:
主要成分合成树脂(高聚物),还含有增塑剂和防老化剂等添加剂,一定属人工合成的。
热塑性塑料:线形结构受热会熔化、冷却会硬化,多次使用,如聚乙烯塑料,聚丙烯塑料等
热固性塑料:受热会交联成立体网状结构,一次使用酚醛树脂,脲醛树脂等
纤维:
天然纤维:属纤维素,棉花、麻等属蛋白质:羊毛和蚕丝等
人造纤维:用木材等为原料加工成的人造棉、人造丝、玻璃纸等仍属纤维素
合成纤维(六大纶) 用石油、天然气、煤核农副产品等为原料人工合成的高分子材料 锦纶(尼龙)、涤纶(的确良)、腈纶(人造羊毛)、维纶、氯纶、丙纶
橡胶:
(1)天然橡胶:聚异戊二烯
(2)合成橡胶:
通用橡胶:丁苯橡胶、氯丁橡胶、顺丁橡胶
特种橡胶:耐热耐酸碱的氟橡胶、耐高温耐严寒的硅橡胶
一般橡胶:线型结构,可塑性好,但强度和韧性差
硫化橡胶:加硫后通过硫桥交联成立体型的网状结构,强度和韧性高、弹性好、化学稳定
与“下列物质与其用途相符合的是[ ]①N2-保护气 ②SiO2-光导纤维 ③A...”考查相似的试题有:
- 某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。(1)按图连接好实验装置。检查装置的气密性...
- 下列说法中正确的是( )A.所有铵盐受热均可以分解,产物均有NH3B.所有铵盐都易溶于水,不是所有铵盐中的氮均呈-3价C.NH4Cl...
- 在3NO2+ H2O ="=" 2HNO3+ NO的反应中,NO2A.是还原剂B.既是氧化剂又是还原剂C.是氧化剂 D.既不是氧化剂又不是还原剂
- 某化学学习小组同学根据实验室现有的制取氨气的药品,设计了右图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还...
- (1)亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。(1...
- 下列物质的转化在给定条件下能实现的是①Al2O3NaAlO2(aq)Al(OH)3②SSO3H2SO4③FeFe2+Fe3+④Fe2O3FeCl3(aq)无水FeCl3⑤MgCl2(aq)Mg(...
- 在红枣和菠菜等食物中含有丰富的铁,这里的铁应理解为( )A.单质B.分子C.元素D.同位素
- 久置在空气中不会变质的物质是( )A.硫酸亚铁B.食盐C.漂白粉D.烧碱
- 下列各组物质相互混合后,既有气体生成又有白色沉淀生成的是①金属钠投入到FeCl3溶液中②过量的NaOH溶液和铝铵矾[NH4Al(SO4)2]...
- 下列有关金属冶炼的说法中,不正确的是 ( )A.用电解熔融氯化钠的方法得到活泼金属钠B.在加热的情况下利用氢气还原三氧化...