本试题 “用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的一种流程如下(1)在反应3前要将菱锌矿研磨,其目的是__________________。(...” 主要考查您对61. 其它金属及化合物(锌、锰、钙、金等)
工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 61. 其它金属及化合物(锌、锰、钙、金等)
- 工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
锌的单质及化合物:
①单质锌:
物理性质:锌化学符号是Zn,它的原子序数是30。锌是一种蓝白色金属。密度为7.14克/立方厘米,熔点为419.5℃。在室温下,性较脆;100~150℃时,变软;超过200℃后,又变脆。锌的化学性质活泼,在常温下的空气中,表面生成一层薄而致密的碱式碳酸锌膜,可阻止进一步氧化。当温度达到225℃后,锌氧化激烈。燃烧时,发出蓝绿色火焰。锌易溶于酸,也易从溶液中置换金、银、铜等。锌的氧化膜熔点高,但金属锌熔点却很低,所以在酒精灯上加热锌片,锌片熔化变软,却不落下,正是因为氧化膜的作用。锌是第四常见的金属,仅次于铁、铝及铜。
化学性质:2Zn+O2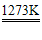 2ZnO Zn+X2
2ZnO Zn+X2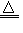 ZnX2(X=F、Cl、Br、I) 3Zn+2P
ZnX2(X=F、Cl、Br、I) 3Zn+2P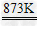 Zn3P2 Zn+S
Zn3P2 Zn+S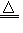 ZnS
ZnS
②氢氧化锌 Zn2++2NaOH==Zn(OH)2+2Na+ Zn(OH)2+2H+==Zn2++H2O Zn(OH)2+2OH-==[Zn(OH)4]2- Zn(OH)2+4NH3+2NH4+==[Zn(NH3)4]2++2H2O Zn(OH)2==ZnO+H2O
[Zn(NH3)4]2++2OH-==Zn(OH)2+4NH3↑
③氯化锌 ZnO+2HCl ZnCl2+H2O ZnCl2+2H2O===Zn(OH)Cl+2HCl ZnCl2+H2O=H2[ZnCl2(OH)2] FeO+H2[ZnCl2(OH)2]==Fe[ZnCl2(OH)]2+H2O Zn+CuCl2=ZnCl2+Cu
ZnCl2+H2O ZnCl2+2H2O===Zn(OH)Cl+2HCl ZnCl2+H2O=H2[ZnCl2(OH)2] FeO+H2[ZnCl2(OH)2]==Fe[ZnCl2(OH)]2+H2O Zn+CuCl2=ZnCl2+Cu
④硫化锌 2ZnO+2S==2ZnS+O2 Zn2++(NH4)2S==ZnS+2NH4+ ZnSO4+BaS==ZnS+BaSO4 Zn2++H2S==ZnS+2H+
⑤锌的配合物(a)[Zn(NH3)4]2+、(b)[Zn(CN)4]2-
钙的单质及化合物:
①单质钙:活泼金属
②氧化钙:俗称生石灰,白色块状固体;与水反应放出大量热,块状固体变成粉末状CaO+H2O==Ca(OH)2
③氢氧化钙:俗称熟石灰,常用来检验二氧化碳气体Ca(OH)2+CO2==CaCO3↓+H2O
④碳酸钙:俗称石灰石,白色固体,不溶于水,常用的建筑材料,实验室常用其和稀盐酸反应制取二氧化碳CaCO3+2HCl==CaCl2+CO2↑+H2O
银的单质及化合物:
①物理性质:银是一种化学元素,化学符号Ag,原子序数47,是一种银白色的贵金属。银性质稳定,质软富有延展性。导热,导电率高,不易受酸碱的腐蚀
②化学性质:银的特征氧化数为+1,其化学性质比铜差,常温下,甚至加热时也不与水和空气中的氧作用。但当空气中含有硫化氢时,银的表面会失去银白色的光泽,这是因为银和空气中的H2S化合成黑色Ag2S的缘故。其化学反应方程式为: 4Ag+H2S+O2=2Ag2S+2H2O
银不能与稀盐酸或稀硫酸反应放出氢气,但银能溶解在硝酸或热的浓硫酸中:2Ag+2H2SO4(浓) Ag2SO4+SO2↑+2H2O
Ag2SO4+SO2↑+2H2O
银在常温下与卤素反应很慢,在加热的条件下即可生成卤化物:
2Ag+F2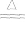 2AgF暗棕色
2AgF暗棕色
2Ag+Cl2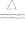 2AgCl白色
2AgCl白色
2Ag+Br2 2AgBr淡黄色
2AgBr淡黄色
2Ag+I2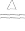 2AgI黄色
2AgI黄色
银对硫有很强的亲合势,加热时可以与硫直接化合成Ag2S:2Ag+S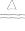 Ag2S
Ag2S
银易溶于硝酸和热的浓硫酸,微溶于热的稀硫酸而不溶于冷的稀硫酸。盐酸和王水只能使银表面发生氯化,而生成氯化银薄膜。
银具有很好的耐碱性能,不与碱金属氢氧化物和碱金属碳酸盐发生作用。
1.确定化工生产的最佳过程
确定化工生产反应原理与过程的一般方法:对于某一具体的化工产品,研究生产过程要从产品的化学组成和性质考虑,来确定原料和生产路线。
①分析产品的化学组成,据此确定生产产品的主要原料;
②分析产品与生产原料之间关键元素的性质,确定主要生产步骤;
③分析生产原料的性质.确定反应原理。
2.选择化工生产的最佳原料
选择原料首先要考虑化学反应原理,此外还要考虑厂址选择、原料供应、能源供应、工业用水供应、产品存储、产品运输、产品预处理成本、环境保护等。
3.控制最佳化学反应条件
控制反应条件是取得化工生产最佳综合效益的重要环节之一。控制反应条件要应用化学反应速率理论和化学平衡原理,结合具体化学反应的特点以及生产技术和设备条件、能源消耗等,控制最佳化学反应速率和反应物的平衡转化率。
4.科学治理工业“三废”
“三废”主要是指废气、废液和废渣。治理“三废” 首先要从设计生产工艺与选择原料做起,即从源头上解决问题;其次是把好排放关,对排出的“三废”的处理,要尽最大努力使其资源化,最低要求是无害化。
5.充分利用“废热”
通过热交换或其他方式利用化学反应所放出的热量。
硫代硫酸钠的工业制法:
(1)亚硫酸钠
将纯碱溶解后,与(硫磺燃烧生成的)二氧化硫作用生成亚硫酸钠,再加入硫磺沸腾反应,经过滤、浓缩、结晶,制得硫代硫酸钠。
Na2CO3+SO2==Na2SO3+CO2 Na2SO3+S+5H2O==Na2S2O3·5H2O
(2)硫化碱法
利用硫化碱蒸发残渣、硫化钡废水中的碳酸钠和硫化钠与硫磺废气中的二氧化硫反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2
(3)氧化、亚硫酸钠和重结晶法
由含硫化钠、亚硫酸钠和烧碱的液体经加硫、氧化;亚硫酸氢钠经加硫及粗制硫代硫酸钠重结晶三者所得硫代硫酸钠混合、浓缩、结晶,制得硫代硫酸钠。
2Na2S+2S+3O2==2Na2S2O3 Na2SO3+S==Na2S2O3
(4)重结晶法
将粗制硫代硫酸钠晶体溶解(或用粗制硫代硫酸钠溶液),经除杂,浓缩、结晶,制得硫代硫酸钠。
砷碱法净化气体副产 利用焦炉煤气砷碱法脱硫过程中的下脚(含Na2S2O3),经吸滤、浓缩、结晶后,制得硫代硫酸钠。
高锰酸钾的工业制法:
工业上利用二氧化锰制备高锰酸钾,其步骤是
(1)二氧化锰与氢氧化钾共熔并通入氧气:2MnO2+4KOH+O2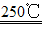 2K2MnO4+2H2O
2K2MnO4+2H2O
(2)电解锰酸钾溶液:2K2MnO4+2H2O 2KMnO4+H2↑+2KOH
2KMnO4+H2↑+2KOH
高锰酸钾常见的制备方法有以下两矿石中取得的二氧化锰和氢氧化钾在空气中或混合硝酸钾(提供氧气)加热,产生锰酸钾,再于碱性溶液中与氧化剂进行电解氧化得到高锰酸钾。 2MnO2+4KOH+O2→2K2MnO4+2H2O 2K2MnO4+Cl2→2KMnO4+2KCl
也可以用MnSO4在酸性环境中和二氧化铅(PbO2)或铋酸钠(NaBiO3)等强氧化剂反应产生。此反应也用于检验二价锰离子的存在,因为高锰酸钾的颜色明显种:
①法一:以MnO2(软锰矿)为原料制KMnO4
第一步:Mn(IV)→Mn(VI) 2MnO2+4KOH+O2====2K2MnO4+2H2O
第二步:CO2歧化K2MnO4 K2MnO4+2CO2====2KMnO4+MnO2+2K2CO3
这种制备方法的最高产率为66.7% 法
②电解法:阳极:2MnO42--2e-→2MnO4- 阴极:2H2O+2e-→H2↑+2OH- 总电解反应方程式为2K2MnO4+2H2O→2KMnO4+2KOH+H2↑
理论产率可达100%
纯硅的制取:
工业上在电炉内,用硅石和碳反应得粗硅和一氧化碳,然后用粗硅和氯气反应得四氯化硅,再用四氯化硅和氢气反应的纯硅和氯化氢,这样就完成硅的制造。(第一步完全相同,第二部有三种方法,工业上用的的是西门子的方法,其他两种不常见。)反应方程式
(1)石英制硅(冶金级),这一步是粗硅制取硅商业上是由高纯度的石英砂和木头,焦炭和煤使用碳棒电极在电弧炉中制得。在高于1900°C的温度下,依照下列方程式碳把石英砂还原成硅: SiO2+C→Si+CO2. SiO2+2C→Si+2CO. 这一过程所的硅称为冶金级硅。纯度为98%-99%。另外,硅制备办法还有熔盐电解法,即电解熔解的二氧化硅。
(2)高纯硅的制备在制备高纯硅之前,需要把粗硅转化成三氯化氢硅(300°C): Si+3HCl→HSiCl3+H2 接着,通过精馏使SiHCl3与其它氯化物分离,经过精馏的SiHCl3,其杂质水平可低于10-10%的电子级硅要求。然后,提纯后的SiHCl3通过CVD原理在1150°C下制备出多晶硅粉。2HSiCl3→Si+2HCl+SiCl4.
与“用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+...”考查相似的试题有:
- A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A、B、C三种金属的活...
- 主族元素R的最高价氧化物0.112g,溶于水制得100g碱性溶液,其浓度为0.148%,R原子核内含有20个中子。通过计算,推测R是什么元...
- 下列化工生产原理错误的是①可以用电解熔融的氯化钠的方法来制取金属钠②可以用钠加入氯化镁饱和溶液中制取镁③用电冶铝时,原料...
- 化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。(1) X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子...
- 稀士金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列...
- 下列有关铁元素的叙述中正确的是( )A.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:Fe(OH)2
- 2000年5月,保利集团在香港拍卖会上花费3000万港币购回了在八国联军入侵中国火烧圆明园上后流失的国宝,铜铸的牛首、猴首和虎...
- 将22.4g金属粉末混合物,放入足量的稀H2SO4中至无气泡产生为止,共收集到标准状况下的H222.4L,此混合物可能是( )A.锌和铜...
- (6分)(1)Mg(OH)2中混有的Al(OH)3的杂质可以用NaOH除去,请用离子方程式表示____________________(2) Fe3+的检验用离子方程...
- 氮氧化铝(AlON)具有优异的物理、化学性质,具备多晶陶瓷在材料制备方面的优势,是优秀的光学窗口材料,有着广阔的应用前景。...