本试题 “有核电荷数小于18的A、B、C、D四种元素,A元素的原子构成一种单质,可以和黏土混合制成铅笔芯;B单质的体积在空气中占21%;C原子有3个电子层,最外层与最内...” 主要考查您对化学反应方程式的书写
元素的推断
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式的书写
- 元素的推断
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
元素推断题:
元素推断题是中学化学练习中的一种重要题型,该类题型以原子结构、周期表等为题干,集基本概念、基础理论及元素化合物知识于一身,具有综合性比较强的特点。
元素推断的规律:
一、原子结构与元素在周期表中的位置关系的规律
1.周期数=核外电子层数
2.族序数=主族元素的最外层电子数
3.质子数=原子序数=原子的核外电子数
4.主族元素的最高正价=族序数
5.最低负价=最高正价-8
二、根据族序数与周期序数的比值判断金属性与非金属性的强弱(族序数—m;周期—n)
1.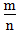 <1时,为金属,
<1时,为金属,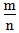 越小,金属性越强
越小,金属性越强
2.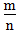 >1时,为非金属,
>1时,为非金属,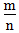 越大,非金属性越强
越大,非金属性越强
3.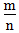 =1时,为两性元素
=1时,为两性元素
三、根据元素的性质,存在及用途的特殊性来推断元素
1.形成化合物种类最多的元素或单质是自然界中硬度最大的物质的元素,或气态氢化物中氢的质量分数最大的元素:C
2.空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N
3.地壳中含量最多的元素,或气态氢化物沸点最高的元素,或氢化物在通常情况下呈液态的元素:O
4.地壳中含量最多的金属元素:Al
5.最活泼的非金属元素,或无正价的元素,或无含氧酸的非金属元素,或无氧酸可腐蚀玻璃的元素,或气态氢化物最稳定的元素,或阴离子的还原性最弱的元素:F
6.最活泼的金属元素,或最高正价氧化物对应的水化物碱性最强的元素,或阳离子氧化性最弱的元素:Cs
7.最容易着火的非金属元素的单质,其元素是:P
8.焰色反应:黄色:Na;紫色:K
9.最轻的单质的元素:H;最轻的金属元素:Li
10.常温下单质呈液态的非金属元素:Br;金属元素:Hg
11.两性元素:Al,Be,Zn
12.元素的气态氢化物和它的最高价氧化物对应的水化物起化合反应的元素:N
13.元素的气态氢化物能和它的氧化物在常温下反应,生成改元素的单质元素:S 14.常见的能形成同素异形体的元素:C,P,O,S
四、周期表中特殊位置的元素
1.族序数=周期数的元素:H,Be,Al
2.族序数=周期数2倍的元素:C
3.族序数=周期数3倍的元素:O
4.周期数是族序数2倍的元素:Li
5.周期数是族序数3倍的饿元素:Na
6.最高正价与最低负价代数和为零的短周期元素:C,Si
7.最高正价是最低负价绝对值3倍的短周期元素:S
8.除H外,原子半径最小的元素:F
9.短周期中离子半径最大的元素:S
10.最高正化合价不等于族序数的元素:F,O 五、元素周期表中的规律
五、元素周期表中的规律
1.各周期的元素种数(n表示周期序数)
(1)n为奇数: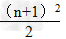
(2)n为偶数: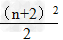
2.元素位置的确定
(1)根据原子结构示意图
①电子层数=周期序数
②最外层电子数=主族序数
(2)根据相近的稀有气体元素的原子序数:未知元素的原子序数-与之最接近的稀有气体元素的原子序数
①得数为正:该稀有气体的下一周期
②得数为负:与该稀有气体在同一周期
3.IIA族与IIIA族原子序数差值规律
(1)不跨过渡+1
(2)跨过过渡+11
(3)跨过锕镧+25
4.同主族元素的原子序数差值规律:左上右下规律
(1)IA族和IIA族(左):b=a+m
(2)IIIA族~VIIA族(右):b=a+n
(a:上一周期元素的原子序数;b:下一周期元素的原子序数;m:上一周期的元素种数;n:下一周期的元素种数)
5.阴上阳下规律:
(1)原子序数相同的阴阳离子,阴离子在上一周期,阳离子在下一周期
(2)离子半径:阴离子>阳离子
(3)原子半径:阴离子对应原子<阳离子对应原子
元素推断题是中学化学练习中的一种重要题型,该类题型以原子结构、周期表等为题干,集基本概念、基础理论及元素化合物知识于一身,具有综合性比较强的特点。
元素推断的规律:
一、原子结构与元素在周期表中的位置关系的规律
1.周期数=核外电子层数
2.族序数=主族元素的最外层电子数
3.质子数=原子序数=原子的核外电子数
4.主族元素的最高正价=族序数
5.最低负价=最高正价-8
二、根据族序数与周期序数的比值判断金属性与非金属性的强弱(族序数—m;周期—n)
1.
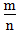 <1时,为金属,
<1时,为金属,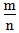 越小,金属性越强
越小,金属性越强2.
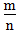 >1时,为非金属,
>1时,为非金属,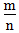 越大,非金属性越强
越大,非金属性越强 3.
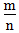 =1时,为两性元素
=1时,为两性元素 三、根据元素的性质,存在及用途的特殊性来推断元素
1.形成化合物种类最多的元素或单质是自然界中硬度最大的物质的元素,或气态氢化物中氢的质量分数最大的元素:C
2.空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N
3.地壳中含量最多的元素,或气态氢化物沸点最高的元素,或氢化物在通常情况下呈液态的元素:O
4.地壳中含量最多的金属元素:Al
5.最活泼的非金属元素,或无正价的元素,或无含氧酸的非金属元素,或无氧酸可腐蚀玻璃的元素,或气态氢化物最稳定的元素,或阴离子的还原性最弱的元素:F
6.最活泼的金属元素,或最高正价氧化物对应的水化物碱性最强的元素,或阳离子氧化性最弱的元素:Cs
7.最容易着火的非金属元素的单质,其元素是:P
8.焰色反应:黄色:Na;紫色:K
9.最轻的单质的元素:H;最轻的金属元素:Li
10.常温下单质呈液态的非金属元素:Br;金属元素:Hg
11.两性元素:Al,Be,Zn
12.元素的气态氢化物和它的最高价氧化物对应的水化物起化合反应的元素:N
13.元素的气态氢化物能和它的氧化物在常温下反应,生成改元素的单质元素:S 14.常见的能形成同素异形体的元素:C,P,O,S
四、周期表中特殊位置的元素
1.族序数=周期数的元素:H,Be,Al
2.族序数=周期数2倍的元素:C
3.族序数=周期数3倍的元素:O
4.周期数是族序数2倍的元素:Li
5.周期数是族序数3倍的饿元素:Na
6.最高正价与最低负价代数和为零的短周期元素:C,Si
7.最高正价是最低负价绝对值3倍的短周期元素:S
8.除H外,原子半径最小的元素:F
9.短周期中离子半径最大的元素:S
10.最高正化合价不等于族序数的元素:F,O 五、元素周期表中的规律
五、元素周期表中的规律
1.各周期的元素种数(n表示周期序数)
(1)n为奇数:
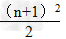
(2)n为偶数:
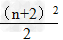
2.元素位置的确定
(1)根据原子结构示意图
①电子层数=周期序数
②最外层电子数=主族序数
(2)根据相近的稀有气体元素的原子序数:未知元素的原子序数-与之最接近的稀有气体元素的原子序数
①得数为正:该稀有气体的下一周期
②得数为负:与该稀有气体在同一周期
3.IIA族与IIIA族原子序数差值规律
(1)不跨过渡+1
(2)跨过过渡+11
(3)跨过锕镧+25
4.同主族元素的原子序数差值规律:左上右下规律
(1)IA族和IIA族(左):b=a+m
(2)IIIA族~VIIA族(右):b=a+n
(a:上一周期元素的原子序数;b:下一周期元素的原子序数;m:上一周期的元素种数;n:下一周期的元素种数)
5.阴上阳下规律:
(1)原子序数相同的阴阳离子,阴离子在上一周期,阳离子在下一周期
(2)离子半径:阴离子>阳离子
(3)原子半径:阴离子对应原子<阳离子对应原子
发现相似题
与“有核电荷数小于18的A、B、C、D四种元素,A元素的原子构成一种...”考查相似的试题有:
- 请根据本小题A、B两图回答下列问题.(1)仪器a的名称是______.(2)写出锥形瓶内反应的化学方程式:______.(3)锥形瓶内...
- 下列各项反应的化学方程式、反应现象及反应类型均正确的是[ ]A.AB.BC.CD.D
- 写出下列变化的文字表达式:①铁丝在氧气中燃烧______;②往水中通电______;③硫在空气中燃烧______;④磷在空气中燃烧______....
- 能源的开发和利用离不开化学。现代社会不仅对能源的需求量越来越大,要求也越来越高,我们已经进入第三次能源革命--多能源时...
- 我市由于干旱少雨,常在必要的情况下,向空中播撒碘化银微粒,进行人工降雨.请根据碘化银的有关性质,在下表中写出相应的化...
- (4分)按要求从氧化铜、氯化钠、硫、氢氧化钠、硫酸、碳酸钙中选择合适的物质,将其化学式填写在下列空格中。(1)一种非金...
- (2011年·衡阳)我国台湾地区近期查出了在饮料等六大类食品中违法添加对人体有害的邻苯二甲酸酯类物质,邻苯二甲酸二(2—乙基...
- 化学与能源、环境关系密切.请你用学过的化学知识回答下列问题:(1)化石燃料包括煤、______、天然气.(2)煤的气化是高效...
- 下图为某反应的微观示意图,其中“ ”和“ ” 表示不同元素的原子。下列说法正确的是A.反应前后原子数目发生改变B.反应前后分子...
- 由同种元素组成的不同单质叫做同素异形体,如O2与O3。下列各组物质属于同素异形体的是( )A.CO和CO2B.金刚石与石墨C.铝条...