本试题 “对于最外层电子排布为(n+1)sn(n+1)p(n+1)的元素及其化合物,在下列叙述中不正确的是[ ]A.氢化物受热易分解B.最高价氧化物对应的水化物是一种强酸C.其单...” 主要考查您对电子排布式
元素的性质
元素周期表
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电子排布式
- 元素的性质
- 元素周期表
电子排布式:
①简化电子排布式
为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的冗素符号外加方括号表示,即为简化电子排布式,如K 的简化电子排布式为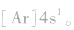
②特殊电子排布式
有个别元素的基态原子的电子排布对于构造原理有1个电子的反常。因为能量相同的原子轨道在全充满( )、半充满(
)、半充满(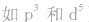 )和全空(
)和全空(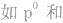
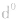 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。 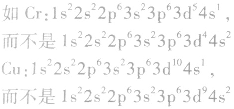
(2)电子排布图:用方框表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。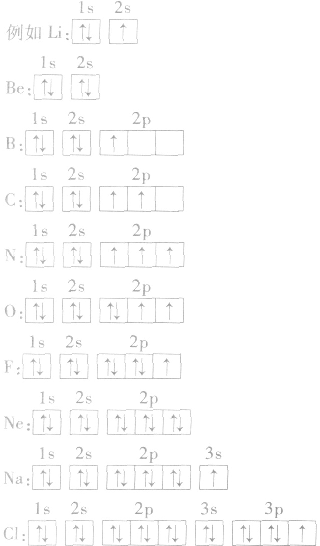
构造原理:
多电子原子的核外电子排布总是按照能量最低原理,由低能级逐步填充到高能级。绝大多数元素的原子核外电子的排布遵循下图所示的排布顺序,这种排布顺序被称为构造原理。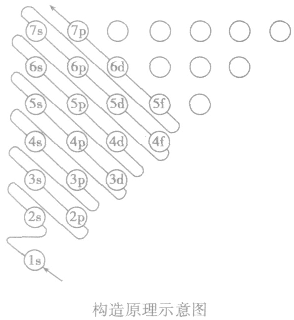
点拨:构造原理中的排布顺序,其实质是各能级的能量高低顺序,可由下列公式得出ns<(n一2)f< (n一1)d<np(n表示能层序数)。常用的重要的能级交错顺序有: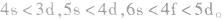
核外电子排布式一构造原理的应用:
根据构造原理,按照能级顺序,用能级符号右上角的数字表示该能级上电子数的式子,叫做电子排布式。例如,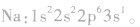
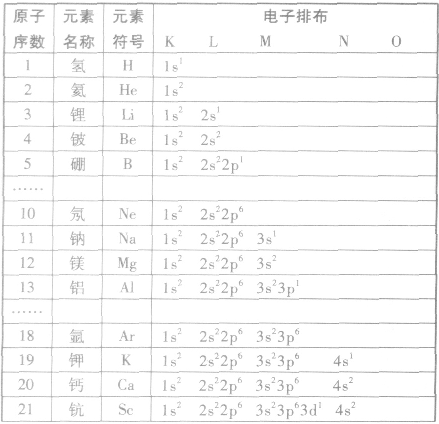
由于核外电子排布的周期性变化,使元素表现出不同的性质。元素性质与原子结构密切相关,主要与原子核外电子排布,特别是最外层电子数有关。
碱金属元素的性质:
(1)元素性质同:均为活泼金属元素,最高正价均为+1价异:失电子能力依次增强,金属性依次增强
(2)单质性质同:均为强还原性(均与O2、X2等非金属反应,均能与水反应生成碱和氢气。),银白色,均具轻、软、易熔的特点异:与水(或酸)反应置换出氢依次变易,还原性依次增强,密度趋向增大,熔沸点依次降低,硬度趋向减小
(3)化合物性质
同:氢氧化物都是强碱。过氧化物M2O2具有漂白性,均与水反应产生O2;异:氢氧化物的碱性依次增强。
注: ①Li比煤油轻,故不能保存在煤油中,而封存在石蜡中。 ②Rb,Cs比水重,故与水反应时,应沉在水底。③与O2反应时,Li为Li2O;Na可为Na2O,Na2O2;K,Rb,Cs的反应生成物更复杂。
卤族元素的性质:
(1)相似性:
①卤素原子最外层都有七个电子,易得到一个电子形成稀有气体元素的稳定结构,因此卤素的负价均为-1价。氯、溴、碘的最高正价为+7价,有的还有+1、+3、+5价,其最高价氧化物及水化物的化学式通式分别为X2O7和HXO4(F除外)
②卤族元素的单质均为双原子分子(X2);均能与H2化合:H2+X2=2HX;均能与水不同程度反应,其通式(除F2外)为:H2O+X2
 HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。
HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。 (2)递变性:
①原子序数增大,原子的电子层数增加,原子半径增大,元素的非金属性减弱。
②单质的颜色逐渐加深从淡黄绿色→黄绿色→深红棕色→紫黑色,状态从气→气→液→固,溶沸点逐渐升高;得电子能力逐渐减弱,单质的氧化性逐渐减弱,与氢气化合由易到难,与水反应的程度逐渐减弱。
③阴离子的还原性逐渐增强。
④氢化物的稳定性逐渐减弱。
⑤最高正价含氧酸的酸性逐渐减弱(氟没有含氧酸)。
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
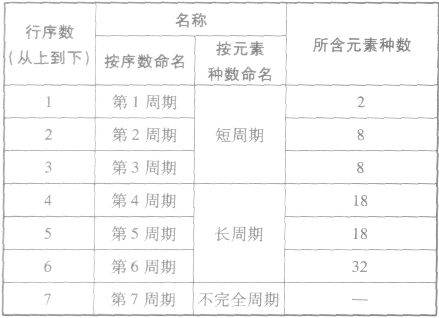
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
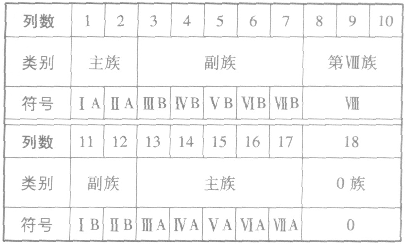
(2)族
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
(3)元素周期表中主族元素金属性和非金属性的递变
与“对于最外层电子排布为(n+1)sn(n+1)p(n+1)的元素及其化合物...”考查相似的试题有:
- Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增。已知:①Q为元素周期表中原子半径最小的元素;②R的基态原子中电子占据...
- 下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d 均是热和电的良导体。(1)请写出上图中b单质对应元素原子的...
- 已知A、B、C、D、E为五种短周期元素构成的离子,A、B、C、D含有10e-,E为双核18e-离子,回答以下问题:(1)A与B形成的化合物...
- (3分)下列物质能导电的是 属于电解质的是 ,属于非电解质的是 。①水银 ②烧碱 ③大理石 ④氯化钠晶体 ⑤盐酸⑥氨气 ⑦蔗糖 ⑧氯气 ...
- “生态马路”是运用光触媒技术,即在马路上铺设“光触媒”(如二氧化钛)物质,将空气中的氮氧化物、一氧化碳、二氧化硫等污染物...
- 下列说法中,正确的是A.单质Si具有半导体性质,故可用于制作硅整流器、硅太阳能电池B.将Na2O2投入NH4Cl只可能生成一种气体C...
- X、Y、Z为短周期元素,原子序数依次增大.X的最外层电子数是Y原子最外层电子数的2倍,质子数比Y少5,X和Z在同一主族。下列叙...
- 微量元素硒(Se)对人体有保健作用,已知硒为第四周期第ⅥA族元素,根据它在周期表中的位置推测,下列对硒元素性质的描述不正...
- 下列元素一定属于主族元素的是[ ]A.位于元素周期表ⅡA族右边的元素B.原子核外最外层上有两个电子的元素C.原子核外最外层为8...
- 下列关于原子结构、元素性质的说法正确的是( )A.ⅠA族元素的金属性一定比ⅡA族元素的金属性强B.族序数等于其周期序数的元素...