本试题 “下列叙述正确的是[ ]A.Li在氧气中燃烧主要生成Li2O2B.Na2O、Na2O2组成元素相同,与CO2反应的产物也相同C.将CO2通入次氯酸钙溶液中可生成次氯酸D.新制氯水...” 主要考查您对氧化钠
过氧化钠
氯水
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化钠
- 过氧化钠
- 氯水
氧化钠的基本性质:
白色固体,碱性氧化物,不稳定
(1)与水反应:Na2O+H2O==2NaOH
(2)与CO2反应:Na2O+CO2==Na2CO3
(3)与HCl反应:Na2O+2HCl==2NaCl+H2O
氧化钠与过氧化钠的比较:
| 物质 | 氧化钠 | 过氧化钠 |
| 色态 | 白色固体 | 淡黄色固体 |
| 类别 | 碱性氧化物 |
过氧化物(不属于碱性氧化物) |
| 化学键类型 | 仅含离子键 | 离子键和非极性键 |
| 电子式 | 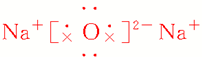 |
 |
| 生成条件 | 常温 | 点燃或加热 |
| 氧的化合价 | -2 | -1 |
| 阴阳离子个数比 | 1:2 | 1:2 |
| 稳定性 | 不稳定 | 稳定 |
| 转化关系 | 2Na2O+O2=2Na2O2 | |
| 用途 | 用于制取少量过氧化钠 | 供氧剂、漂白剂、氧化剂 |
| 与水反应方程式 | 2Na2O+2H2O=2NaOH | 2Na2O2+2H2O=4NaOH+O2↑ |
| 与CO2反应 | Na2O+CO2=NaCO3 | 2Na2O2+2CO2=2Na2CO3+O2↑ |
| 与HCl反应 | Na2O+2HCl=2NaCl+H2O | 2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
| 保存 | 隔绝空气、密封保存 | 隔绝空气、远离易燃物、密封保存 |
过氧化钠(Na2O2)的基本性质:
淡黄色固体,较稳定,可用作供氧剂、漂白剂
(1)与水反应:2Na2O2+2H2O==4NaOH+O2↑
(2)与CO2反应:2Na2O2+2CO2==2Na2CO3+ O2
(3)与HCl反应:2Na2O2+4HCl==4NaCl+2H2O+ O2↑
过氧化钠的特性及计算:
1.过氧化钠的强氧化性
2.Na2O2与CO2、H2O(g)反应的重要关系
(1)气体体积差的关系
2Na2O2+2CO2===2Na2CO3+O2 气体体积差 ①
2 1 ΔV=1
2Na2O2+2H2O(g)===4NaOH+O2 气体体积差 ②
2 1 ΔV=1
由此可见,若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量是原气体体积的1/2,即为生成氧气的量。
(2)先后顺序关系
一定量的Na2O2与一定量的CO2和H2O(g)的混合物反应,可视为Na2O2首先与CO2反应,剩余的Na2O2再与H2O(g)反应。
(3)电子转移关系
当Na2O2与CO2或H2O反应时,每产生1molO2就转移2mol电子。
(4)固体质量变化关系
①足量过氧化钠与水、CO2反应的计算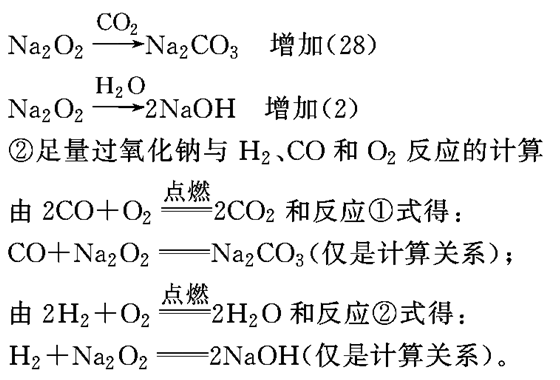
所以,有ag通式符合(CO)m(H2)n(m=0,1,2,3…,n=0,1,2,3…)的物质(包括纯净物和混合物)在氧气中燃烧,将其通过足量过氧化钠,反应完毕后,固体增重ag。
氧化钠与过氧化钠的比较:
| 物质 | 氧化钠 | 过氧化钠 |
| 色态 | 白色固体 | 淡黄色固体 |
| 类别 | 碱性氧化物 |
过氧化物(不属于碱性氧化物) |
| 化学键类型 | 仅含离子键 | 离子键和非极性键 |
| 电子式 | 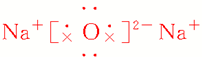 |
 |
| 生成条件 | 常温 | 点燃或加热 |
| 氧的化合价 | -2 | -1 |
| 阴阳离子个数比 | 1:2 | 1:2 |
| 稳定性 | 不稳定 | 稳定 |
| 转化关系 | 2Na2O+O2=2Na2O2 | |
| 用途 | 用于制取少量过氧化钠 | 供氧剂、漂白剂、氧化剂 |
| 与水反应方程式 | 2Na2O+2H2O=2NaOH | 2Na2O2+2H2O=4NaOH+O2↑ |
| 与CO2反应 | Na2O+CO2=NaCO3 | 2Na2O2+2CO2=2Na2CO3+O2↑ |
| 与HCl反应 | Na2O+2HCl=2NaCl+H2O | 2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
| 保存 | 隔绝空气、密封保存 | 隔绝空气、远离易燃物、密封保存 |
特别提醒:
(1)用脱脂棉包裹住过氧化钠,滴加少量水时脱脂棉可以燃烧,不仅可以说明Na2O2与H2O反应生成O2,还可以说明该反应放热。
(2)Na2O2与H2O反应时H2O既不是氧化剂也不是还原剂。
方法技巧:Na2O与Na2O2的结构与性质
(1)Na2O中只含离子键,Na2O2中既含离子键,又含非极性键。
(2)等物质的量的Na2O与Na2O2分别于等量且足量的H2O反应,所得溶液的成分浓度相同
氯水的成分:
新制氯水中存在的分子有盐酸(HCl)、次氯酸(HClO),水(H2O)、还有氯气
氯水的性质:
新制氯水呈黄绿色、有刺激性气味,属于混合物,其所含的多种微粒使氯水的化学性质表现出多重性。
①氯水的Cl2氧化性,只表现氯水的氧化性
A. 在某些含非金属阴离子的溶液中加氯水。
| 氯水滴加溶液 | 反应方程式 | 实验现象 |
| KI溶液 | 2KI+Cl2==2KCl+I2 | 溶液由无色变橙黄色 |
| NaBr溶液 | 2NaBr+Cl2==NaCl+Br2 | 溶液由无色变橙色 |
| K2S溶液 | K2S+Cl2==2KCl+S↓ | 溶液变浑浊 |
| Na2SO3溶液 | Na2SO3+Cl2+H2O==Na2SO4+2HCl | 氯水颜色褪去 |
C. 某些强还原性的气体通入氯水中,氯气将其氧化。
| 通入的气体 | 化学方程式 | 实验现象 |
| H2S | H2S+Cl2==2HCl+S↓ | 溶液出现浑浊 |
| HBr | 2HBr+Cl2==2HCl+Br2 | 溶液由浅黄绿色变橙色 |
| HI | 2HI+Cl2==2HCl+I2 | 溶液由浅黄色变橙黄色 |
| SO2 | SO2+Cl2+2H2O==H2SO4+2HCl | 溶液浅黄色褪去 |
A. 新制氯水滴入NaOH溶液等强碱溶液中,氯水褪色:
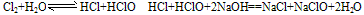
B. 新制氯水中滴加紫色石蕊试液时,溶液先变红色,后褪色,是盐酸的强酸性和次氯酸的强氧化性共同作用的结果。 ③氯水中次氯酸的强氧化性。
新制氯水起漂白作用时,是由于HClO的强氧化性将色素氧化使之褪色的结果,也是Cl2的漂白、杀菌、消毒作用必须有水存在的根本原因。
④氯水中盐酸的强酸性。
在AgNO3溶液中滴加适量的氯水,有白色沉淀生成。是氯水中的HCl与AgNO3作用的结果。
⑤氯水中盐酸的强酸性和氯气的强氧化性共同起作用。
向氯水中加镁粉、铝粉等活泼金属时,可观察到氯水颜色褪去且有气泡冒出,氯水中的Cl2和HCl与镁、铝共同作用的结果。
有关氯水问题的分析方法:
1.氯水性质的多样性
氯气溶于水形成的溶液叫氯水,新制的氯水呈浅黄绿色,有刺激性气味。氯水中存在三个平衡:
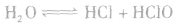 ,
,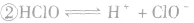 ,
,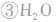
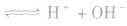 。所以,在氯水中存在三种分子:Cl2、 H2O、HClO;四种离子:H+、Cl-、ClO-及少量OH-。由于在光照条件下HClO可分解
。所以,在氯水中存在三种分子:Cl2、 H2O、HClO;四种离子:H+、Cl-、ClO-及少量OH-。由于在光照条件下HClO可分解
 ,故久置的氯水为盐酸。
,故久置的氯水为盐酸。
(1)氯水的性质氯水在与不同物质发生反应时,表现出成分的复杂性和性质的多样性。
说明:
①氯水通常现用现制,可短时间密封保存于棕色试剂瓶中(见光或受热易分解的物质均保存在棕色试剂瓶中);
②Cl:使湿润的蓝色石蕊试纸先变红,后褪色。
(2)新制氯水、久置氯水、液氯的区别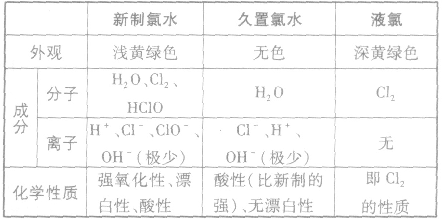
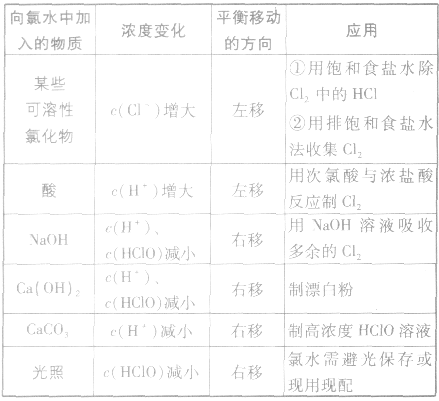
外界因素对平衡 的影响:
的影响:
卤离子的检验方法:
1.银盐法:
特别提醒:加入稀HNO3的目的是防止CO32-、 PO43-等离子的干扰。有关反应为: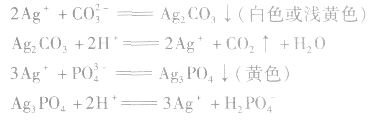
2.置换一萃取法
3.置换一淀粉法检验I-
与“下列叙述正确的是[ ]A.Li在氧气中燃烧主要生成Li2O2B.Na2O...”考查相似的试题有:
- 下列对于过氧化钠的叙述中,正确的是( )A.将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色B.1 mol Na2O2与H2O完全反应,...
- 下列关于钠的氧化物的说法正确的是( )A.Na2O2是白色固体,与冷水作用放出氧气,生成氢氧化钠B.在Na2O2与CO2的反应中,氧化...
- 过氧化钠保存不当容易变质,生成Na2CO3。(1)某过氧化钠样品已经部分变质,请你选择一种溶液 ,证明过氧化钠已经变质。 (2...
- ①氧化钠 ②氢氧化钠 ③过氧化钠 ④钠,1mol上述固体物质长期放置于空气中,下列说法正确的是[ ]A.上述物质都有发生了氧化还原反...
- 下列装置可用于某些气体的制备、干燥、性质的验证和尾气的处理(加热及夹持固定装置均略去),请回答下列问题(仪器装置可任...
- 有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( ) A.将等浓度的Na2CO3溶液和NaHCO3溶液混合,向其中逐滴加入稀盐酸,首先...
- 把一定量的铁粉放入氯化铁溶液中,充分反应后所得溶液中Fe3+和Fe2+的浓度恰好相等,则反应的铁和未反应的Fe3+的物质的量之比...
- 我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如下:(1)完成有关反应的化学...
- 现有下列短周期元素性质的数据回答下列问题(1)元素③在周期表中位置是_____________;元素④与元素⑦相比较,气态氢化物较稳定...
- 向某溶液中加入含Fe2+的溶液后,无明显变化。当再加入几滴新制氯水后,混合液变成红色,则下列结论错误的是[ ]A.该溶液中一...