本试题 “(1)用化学符号表示:①氮元素______;②3个氢氧根离子____;③2个铝离子_____。④4个镁原子____________(2)从下列物质中选择填空(填序号):a铜 b熟石灰 c干冰...” 主要考查您对氧气的性质
原子结构示意图
离子符号的意义及写法
元素符号的意义及写法
金属的物理性质和用途
二氧化碳的用途
中和反应及在实际中的应用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧气的性质
- 原子结构示意图
- 离子符号的意义及写法
- 元素符号的意义及写法
- 金属的物理性质和用途
- 二氧化碳的用途
- 中和反应及在实际中的应用
定义:
氧气,空气主要组分之一,比空气重,标准状况(0℃和大气压强101325帕)下密度为1.429克/升。无色、无臭、无味。在水中溶解度很小。压强为101kPa时,氧气在约-183摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气的性质:
1.氧气的物理性质:
(1)无色无味,标况下,氧气的密度为1.429g/L,密度比空气大,难溶于水,1L水中只能溶解约30ml的氧气。
(2)三态变化:氧气(无色气体) 液氮(淡蓝色液体)
液氮(淡蓝色液体)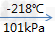 固态氮(淡蓝色雪花状)
固态氮(淡蓝色雪花状)
(3)工业产生的氧气,一般加压贮存在蓝色的钢瓶中。
2.氧气的化学性质:
(1)化学性质较活泼,在一定条件下,可以和多种物质发生化学反应,同时放出热量;具有助燃性和氧化性,在化学反应中提供氧,是一种常用的氧化剂。
(2)助燃性,氧化性
①与金属的反应:
2Mg+O2 2MgO
2MgO
3Fe+2O2 Fe3O4
Fe3O4
②与非金属的反应:
C+O2 CO2(O2充分)
CO2(O2充分)
2C+O2 2CO(O2不充分)
2CO(O2不充分)
③与化合物的反应:
2CO+O2 2CO2
2CO2
CH4+2O2 CO2+2H2O
CO2+2H2O
C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
易错点:
(1)误认为氧气具有可燃性,可以做燃料
氧气可以帮助可燃物燃烧,具有助燃性,它本身不能燃烧,不能做可燃物。
(2)误认为氧气的化学性质非常活泼,能与所有物质发生反应
氧气是一种化学性质非常活泼的气体,在一定条件下能与许多物质发生化学反应,但不是与所有物质都能发生化学反应。
(3)误认为燃烧都需要氧气
燃烧有广义和狭义之分,通常所说的燃烧是指可燃物与氧气发生的一种发光,放热的剧烈的氧化反应。燃烧的条件之一是需要氧气。但有一些燃烧不需要氧气,如镁在二氧化碳中也能燃烧。
(4)误认为物质与氧气的反应叫氧化反应
氧化反应是物质与氧发生的反应,其中包括物质与氧气中的氧元素发生的反应,也包括物质与其他含氧物质中的氧元素发生的反应。如氢气与氧气反应生成水是氧化反应,氢气与氧化铜反应生成铜和水也是氧化反应。
(5)误认为氧气与液氧性质不行
物质的性质包括物理性质和化学性质,氧气与液氧物理性质不同,但化学性质是相同的,因为它们二者的分子构成相同,都是由氧分子构成的。
(6)误认为含氧的物质都能制取氧气。
制取氧气需要含氧的物质,但不是所有的含氧物质都能用来制取氧气。
氧气,空气主要组分之一,比空气重,标准状况(0℃和大气压强101325帕)下密度为1.429克/升。无色、无臭、无味。在水中溶解度很小。压强为101kPa时,氧气在约-183摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气的性质:
1.氧气的物理性质:
(1)无色无味,标况下,氧气的密度为1.429g/L,密度比空气大,难溶于水,1L水中只能溶解约30ml的氧气。
(2)三态变化:氧气(无色气体)
 液氮(淡蓝色液体)
液氮(淡蓝色液体) 固态氮(淡蓝色雪花状)
固态氮(淡蓝色雪花状)(3)工业产生的氧气,一般加压贮存在蓝色的钢瓶中。
2.氧气的化学性质:
(1)化学性质较活泼,在一定条件下,可以和多种物质发生化学反应,同时放出热量;具有助燃性和氧化性,在化学反应中提供氧,是一种常用的氧化剂。
(2)助燃性,氧化性
①与金属的反应:
2Mg+O2
 2MgO
2MgO3Fe+2O2
 Fe3O4
Fe3O4②与非金属的反应:
C+O2
 CO2(O2充分)
CO2(O2充分)2C+O2
 2CO(O2不充分)
2CO(O2不充分)③与化合物的反应:
2CO+O2
 2CO2
2CO2CH4+2O2
 CO2+2H2O
CO2+2H2OC2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O易错点:
(1)误认为氧气具有可燃性,可以做燃料
氧气可以帮助可燃物燃烧,具有助燃性,它本身不能燃烧,不能做可燃物。
(2)误认为氧气的化学性质非常活泼,能与所有物质发生反应
氧气是一种化学性质非常活泼的气体,在一定条件下能与许多物质发生化学反应,但不是与所有物质都能发生化学反应。
(3)误认为燃烧都需要氧气
燃烧有广义和狭义之分,通常所说的燃烧是指可燃物与氧气发生的一种发光,放热的剧烈的氧化反应。燃烧的条件之一是需要氧气。但有一些燃烧不需要氧气,如镁在二氧化碳中也能燃烧。
(4)误认为物质与氧气的反应叫氧化反应
氧化反应是物质与氧发生的反应,其中包括物质与氧气中的氧元素发生的反应,也包括物质与其他含氧物质中的氧元素发生的反应。如氢气与氧气反应生成水是氧化反应,氢气与氧化铜反应生成铜和水也是氧化反应。
(5)误认为氧气与液氧性质不行
物质的性质包括物理性质和化学性质,氧气与液氧物理性质不同,但化学性质是相同的,因为它们二者的分子构成相同,都是由氧分子构成的。
(6)误认为含氧的物质都能制取氧气。
制取氧气需要含氧的物质,但不是所有的含氧物质都能用来制取氧气。
概念:
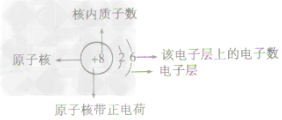
原子结构示意图(如图)是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
原子结构示意图及各部分的含义:
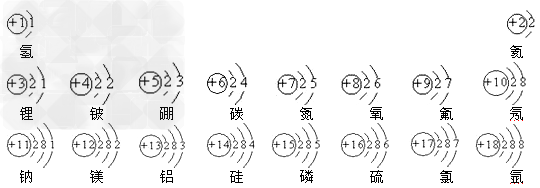
前20号元素的原子结构示意图:
原子结构示意图(如图)是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
原子结构示意图及各部分的含义:

前20号元素的原子结构示意图:

离子的定义:
带电的原子或原子团叫离子。
离子的分类:
阳离子:带正电荷的原子或原子团,如:K+、NH4+
阴离子:带负电荷的原子或原子团,如:Cl-、SO42-。
离子的形成(以Na+、Cl-的形成为例) :
①钠在氯气中燃烧生成氯化钠:2Na+Cl2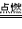 2NaCl。钠与氯气反应时,每个钠原子失去1个电子形成钠离子(Na+),每个氯原子得到1个电子形成氯离子(Cl-),Na+与Cl-由于静电作用而结合成化合物氯化钠(NaCl)
2NaCl。钠与氯气反应时,每个钠原子失去1个电子形成钠离子(Na+),每个氯原子得到1个电子形成氯离子(Cl-),Na+与Cl-由于静电作用而结合成化合物氯化钠(NaCl)

②从原子结构示意图分析Na+,Cl-的形成过程:

离子的表示方法——离子符号
在元素符号的右上角用“+”,“-”号表示离子的电性,数字表示离子所带的电荷,先写数字后写正负号,当数字为1 时,省略不谢。如Na+,Cl-,Mg2+,O2-。
原子团:
①有一些物质如Ca(OH)2,CaCO3等,它们中的一些原子集团如OH-、CO32-,常作为一个整体参加反应,这样的原子集团,叫做原子团,又叫做根。
②命名:原子团不能独立稳定地存在,它是物质 “分子”组成的一部分。
初中化学中的原子团除铵根 (NH4+)在化学式前面部分外,其他原子团在化学式的后一部分一般命名“xx根”,
如下面画线部分为原子团: NH4Cl(铵根)Na2CO3(碳酸根)K2SO4(硫酸根)NaOH(氢氧根)KNO3(硝酸根)KMnO4(高锰酸根)K2MnO4(锰酸根)KClO3(氯酸根) NH4NO3(铵根,硝酸根)
其他原子团有:SO32-(亚硫酸根)、NO2-(亚硝酸根),HSO3-(亚硫酸氢根),H2PO4-(磷酸二氢根)等。
关系式:
阳离子所带正电荷数=原子失去电子数=质子数-核外电子数
阴离子所带负电荷数=原子得到电子数=核外电子数-质子数
带电的原子或原子团叫离子。
离子的分类:
阳离子:带正电荷的原子或原子团,如:K+、NH4+
阴离子:带负电荷的原子或原子团,如:Cl-、SO42-。
离子的形成(以Na+、Cl-的形成为例) :
①钠在氯气中燃烧生成氯化钠:2Na+Cl2
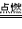 2NaCl。钠与氯气反应时,每个钠原子失去1个电子形成钠离子(Na+),每个氯原子得到1个电子形成氯离子(Cl-),Na+与Cl-由于静电作用而结合成化合物氯化钠(NaCl)
2NaCl。钠与氯气反应时,每个钠原子失去1个电子形成钠离子(Na+),每个氯原子得到1个电子形成氯离子(Cl-),Na+与Cl-由于静电作用而结合成化合物氯化钠(NaCl)
②从原子结构示意图分析Na+,Cl-的形成过程:

离子的表示方法——离子符号
在元素符号的右上角用“+”,“-”号表示离子的电性,数字表示离子所带的电荷,先写数字后写正负号,当数字为1 时,省略不谢。如Na+,Cl-,Mg2+,O2-。
原子团:
①有一些物质如Ca(OH)2,CaCO3等,它们中的一些原子集团如OH-、CO32-,常作为一个整体参加反应,这样的原子集团,叫做原子团,又叫做根。
②命名:原子团不能独立稳定地存在,它是物质 “分子”组成的一部分。
初中化学中的原子团除铵根 (NH4+)在化学式前面部分外,其他原子团在化学式的后一部分一般命名“xx根”,
如下面画线部分为原子团: NH4Cl(铵根)Na2CO3(碳酸根)K2SO4(硫酸根)NaOH(氢氧根)KNO3(硝酸根)KMnO4(高锰酸根)K2MnO4(锰酸根)KClO3(氯酸根) NH4NO3(铵根,硝酸根)
其他原子团有:SO32-(亚硫酸根)、NO2-(亚硝酸根),HSO3-(亚硫酸氢根),H2PO4-(磷酸二氢根)等。
关系式:
阳离子所带正电荷数=原子失去电子数=质子数-核外电子数
阴离子所带负电荷数=原子得到电子数=核外电子数-质子数
表示方法:
为了书写和学术交流的方便,采用国际统一的符号来表示各种元素,如:氢元素用“H”来表示,铁元素用“Fe”来表示等。
元素符号的写法:
①由一个字母表示的元素符号要大写,如:H、C、 S、P,K。
②由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”)。如:Na、Mg、 Ca、Zn、Si。
为了书写和学术交流的方便,采用国际统一的符号来表示各种元素,如:氢元素用“H”来表示,铁元素用“Fe”来表示等。
元素符号的写法:
①由一个字母表示的元素符号要大写,如:H、C、 S、P,K。
②由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”)。如:Na、Mg、 Ca、Zn、Si。
元素符号和化学式的关系:
| 化学用语 | 元素符号 | 化学式 | |
| 意义 | 宏观 | 表示一种元素 表示一种物质(由原子构成的物质) |
表示这种物质 表示这种物质由几种元素组成 |
| 微观 | 表示该元素的一个原子 | 表示这种物质的一个分子〔由分子构成的物质) 表示一个分子含有各原子的个数(由分子构成的物质) | |
| 量的意义 | —— | 表示这种物质的相对分子质量 表示这种物质中各元素的原子个数比和质量之比 表示物质中各组成元素的质量分数 | |
| 举例 | H 表示氢元素 表示一个氢原子 |
H2O 表示水 表示水是由氢元素和氧元素组成的 表示1个水分子 表示1个水分子中含有2个氢原子和1个氧原子 | |
| 注意事项 | 单独的化学式和元素符号,既有宏观意义,又有微观意义化学式和元素符号前加上数字,则只表示微观意义,即只表示相应的粒子个数,如“2H”表示两个氢原子,"3H2O"表示三个水分子化学式中元素符号右下角的数字表示每个分子中所含该元素原子的个数,如“CO2”中的”2”表示一个二氧化碳分子中含有两个氧原子 | ||
概述:
金属是一种具有光泽(即对可见光强烈反射)、富有延展性、容易导电、导热等性质的物质。金属的上述特质都跟金属晶体内含有自由电子有关。在自然界中,绝大多数金属以化合态存在,少数金属例如金、铂、银、铋以游离态存在。金属矿物多数是氧化物及硫化物。其他存在形式有氯化物、硫酸盐、碳酸盐及硅酸盐。金属之间的连结是金属键,因此随意更换位置都可再重新建立连结,这也是金属伸展性良好的原因。金属元素在化合物中通常只显正价。
金属物理性质的共性:
大多数金属在常温下是固体,具有金属光泽,是电和热的良导体,具有良好的延展性,密度较大,熔沸点较高。
金属物理性质的特性:
不同的金属有其各自的特性。如铁、铝等大多数金属都呈银白色,但铜呈红色,金呈黄色;常温下,铁、铝、铜等大多数金属都是固体,但汞是液体;不同金属的导电性、导热性、密度、熔点、硬度等物理性质差别也较大,见下表。
用途:
钛和钛的合金:可用于制造喷气发动机,轮船外壳,反应器和电信器材。
锌:锌镀在铁的表面,以防止铁被腐蚀;锌还常用于电镀、制造铜合金和干电池。
铜:制造电线、电缆和各种电器。
铝:来冶炼高熔点金属;导电性仅次于银和铜,常用于制造电线和电缆。
物质的性质和用途的关系:
①物质的性质在很大程度上决定了物质的用途,但实际运用时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
②应用举例
a.日常生活中菜刀、镰刀、锤子等用铁制而不用铅制,这是因为铁的硬度比铅大,并且铅对人体有害。
b.虽然银的导电性比铜好,但由于银的价格比铜高得多,所以电线一般用铜制而不用银制。
c.灯泡里的灯丝用钨制而不用锡制,这是因为钨是熔点最高的金属,高温时钨丝不易熔化;而锡的熔点最低 (只有232℃),如果用锡制灯丝,只要一开灯,灯丝就会断开,灯泡不能发光。 d.铁制水龙头要镀铬,这是因为镀铬既美观,又耐腐蚀,可延长水龙头的使用寿命。
e.在日常生活中我们还经常用到其他金属,如温度计中的液态金属汞、干电池的锌皮、热水瓶内胆上镀的金属银等。
金属是一种具有光泽(即对可见光强烈反射)、富有延展性、容易导电、导热等性质的物质。金属的上述特质都跟金属晶体内含有自由电子有关。在自然界中,绝大多数金属以化合态存在,少数金属例如金、铂、银、铋以游离态存在。金属矿物多数是氧化物及硫化物。其他存在形式有氯化物、硫酸盐、碳酸盐及硅酸盐。金属之间的连结是金属键,因此随意更换位置都可再重新建立连结,这也是金属伸展性良好的原因。金属元素在化合物中通常只显正价。
金属物理性质的共性:
大多数金属在常温下是固体,具有金属光泽,是电和热的良导体,具有良好的延展性,密度较大,熔沸点较高。
金属物理性质的特性:
不同的金属有其各自的特性。如铁、铝等大多数金属都呈银白色,但铜呈红色,金呈黄色;常温下,铁、铝、铜等大多数金属都是固体,但汞是液体;不同金属的导电性、导热性、密度、熔点、硬度等物理性质差别也较大,见下表。
| 物理性质 | 物理性质比较 |
| 导电性 |  |
| 密度 |  |
| 熔点 |  |
| 硬度 |  |
用途:
钛和钛的合金:可用于制造喷气发动机,轮船外壳,反应器和电信器材。
锌:锌镀在铁的表面,以防止铁被腐蚀;锌还常用于电镀、制造铜合金和干电池。
铜:制造电线、电缆和各种电器。
铝:来冶炼高熔点金属;导电性仅次于银和铜,常用于制造电线和电缆。
物质的性质和用途的关系:
①物质的性质在很大程度上决定了物质的用途,但实际运用时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
②应用举例
a.日常生活中菜刀、镰刀、锤子等用铁制而不用铅制,这是因为铁的硬度比铅大,并且铅对人体有害。
b.虽然银的导电性比铜好,但由于银的价格比铜高得多,所以电线一般用铜制而不用银制。
c.灯泡里的灯丝用钨制而不用锡制,这是因为钨是熔点最高的金属,高温时钨丝不易熔化;而锡的熔点最低 (只有232℃),如果用锡制灯丝,只要一开灯,灯丝就会断开,灯泡不能发光。 d.铁制水龙头要镀铬,这是因为镀铬既美观,又耐腐蚀,可延长水龙头的使用寿命。
e.在日常生活中我们还经常用到其他金属,如温度计中的液态金属汞、干电池的锌皮、热水瓶内胆上镀的金属银等。
二氧化碳用途:
1.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
2.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
3.工业制纯碱和尿素,是一种重要的化工原料
4.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气
二氧化碳中毒:
二氧化碳中毒是人吸入高浓度的二氧化碳所出现的昏迷及脑缺氧情况,一般大气中二氧化碳含量超过1%时,人即有轻度中毒反应;当超过3%时,开始出现呼吸困难;超过6%时,就会重度中毒甚至死亡。
(1)征状
中毒主要征状有:头痛、头愫晕、耳鸣、气急、胸闷、乏力、心跳加快,面颊发绀、烦躁、谵妄、呼吸困难,如情况持续,就会出现嗜睡、淡漠、昏迷、反射消失、瞳孔散大、大小便失禁、血压下降甚至死亡。
(2)补救
打开门窗、通风孔,抢救者才可进入。将病人救出后,在空气新鲜处进行人工呼吸,心脏按摩,吸氧(避免高压、高流量、高浓度给氧,以免呼吸中枢更为抑制),开始1~2L/分,随病人呼吸好转逐渐增大给氧量(4--5L/分),以至采用高压氧治疗。(最好是纯氧)
吸入兴奋剂:多种兴奋剂交替、联合使用,如洛贝林、山梗菜碱等。
防止脑和肺水肿:应用脱水剂、激素,限制液量和速度,吸入钠的份量亦应限制。
对症治疗:给予多种维生素、细胞色素C、能量合剂、高渗糖,以防感染。
抢救同时要留意有没有其他有毒气体存在,如一氧化碳等。
1.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
2.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
3.工业制纯碱和尿素,是一种重要的化工原料
4.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气
二氧化碳中毒:
二氧化碳中毒是人吸入高浓度的二氧化碳所出现的昏迷及脑缺氧情况,一般大气中二氧化碳含量超过1%时,人即有轻度中毒反应;当超过3%时,开始出现呼吸困难;超过6%时,就会重度中毒甚至死亡。
(1)征状
中毒主要征状有:头痛、头愫晕、耳鸣、气急、胸闷、乏力、心跳加快,面颊发绀、烦躁、谵妄、呼吸困难,如情况持续,就会出现嗜睡、淡漠、昏迷、反射消失、瞳孔散大、大小便失禁、血压下降甚至死亡。
(2)补救
打开门窗、通风孔,抢救者才可进入。将病人救出后,在空气新鲜处进行人工呼吸,心脏按摩,吸氧(避免高压、高流量、高浓度给氧,以免呼吸中枢更为抑制),开始1~2L/分,随病人呼吸好转逐渐增大给氧量(4--5L/分),以至采用高压氧治疗。(最好是纯氧)
吸入兴奋剂:多种兴奋剂交替、联合使用,如洛贝林、山梗菜碱等。
防止脑和肺水肿:应用脱水剂、激素,限制液量和速度,吸入钠的份量亦应限制。
对症治疗:给予多种维生素、细胞色素C、能量合剂、高渗糖,以防感染。
抢救同时要留意有没有其他有毒气体存在,如一氧化碳等。
中和反应:
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
发现相似题
与“(1)用化学符号表示:①氮元素______;②3个氢氧根离子____;③...”考查相似的试题有:
- 做铁丝在氧气中燃烧的实验时,在铁丝一端系上火柴的作用是______,集气瓶里水的作用是______,铁丝绕成螺旋状的目的是______.
- 在空气中,与人类关系最密切的当属氧气.下列说法正确的是( )A.用双氧水制取氧气的反应中,氢元素、氧元素的化合价都没有...
- 某粒子的结构示意图如下图所示,下列对该粒子的判断中,错误的是( )A.原子核内有11个质子B.在化学反应中容易得到电子C....
- 下列说法不正确的是[ ]A.构成物质的分子问有间隔,且分子在不断地运动着B.某金属元素X的原子结构示意图为,X在形成化合物时...
- 请用数字和化学符号填空:(1)2个氯原子_________;(2)儿童缺________会引起食欲不振,发育不良;(3)铵根离子__________...
- 用数字与化学符号表示:(1)地壳中含量最多的金属元素________;(2)保持水的化学性质的微粒______;(3)2个铵根离子_____...
- 下列符号中,既表示一个原子,又表示一种元素,还表示一种物质的是[ ]A.NaClB.FeC.O2D.H
- 下列物质的用途,叙述正确的是( )A.石灰石可用来粉墙B.石墨可用于冰箱除臭C.干冰可用于人工降雨D.用一氧化碳来制汽水饮料
- 下列说法正确的是( )A.酸碱中和反应一定是复分解反应B.分解反应一定有单质生成C.只有两种化合物生成的反应不是复分解反...
- 向一定量的硫酸溶液中,分别加入足量的水、金属锌、氢氧化钠溶液、氯化钡溶液,下列图示正确的是( )