本试题 “(1)下表是A、B、C、D、E五种短周期元素的某些性质①A元素是形成有机物的主要元素,下列分子中采取sp和sp3两种杂化方式的是________B.CH4C.CH2=CHCH3D.CH3CH...” 主要考查您对电子排布式
极性分子、非极性分子
杂化轨道理论(中心原子杂化方式)
晶胞
等电子原理(等电子体)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电子排布式
- 极性分子、非极性分子
- 杂化轨道理论(中心原子杂化方式)
- 晶胞
- 等电子原理(等电子体)
电子排布式:
①简化电子排布式
为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的冗素符号外加方括号表示,即为简化电子排布式,如K 的简化电子排布式为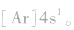
②特殊电子排布式
有个别元素的基态原子的电子排布对于构造原理有1个电子的反常。因为能量相同的原子轨道在全充满( )、半充满(
)、半充满(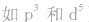 )和全空(
)和全空(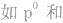
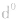 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。 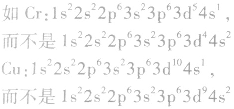
(2)电子排布图:用方框表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。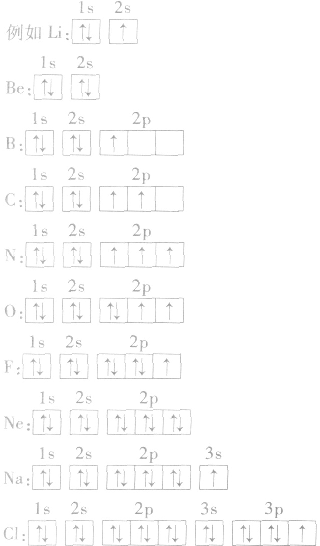
构造原理:
多电子原子的核外电子排布总是按照能量最低原理,由低能级逐步填充到高能级。绝大多数元素的原子核外电子的排布遵循下图所示的排布顺序,这种排布顺序被称为构造原理。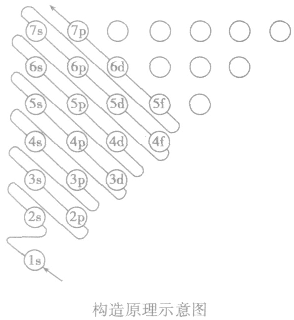
点拨:构造原理中的排布顺序,其实质是各能级的能量高低顺序,可由下列公式得出ns<(n一2)f< (n一1)d<np(n表示能层序数)。常用的重要的能级交错顺序有: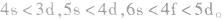
核外电子排布式一构造原理的应用:
根据构造原理,按照能级顺序,用能级符号右上角的数字表示该能级上电子数的式子,叫做电子排布式。例如,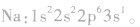
(1)极性分子:正电荷中心和负电荷中心不相重合的分子
(2)非极性分子:正电荷中心和负电荷中心相重合的分子
(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定
非极性分子和极性分子的比较:
| 非极性分子 | 极性分子 | |
| 形成原因 | 整个分子的电荷分布均匀,对称 | 整个分子的电荷分布不均匀、不对称 |
| 存在的共价键 | 非极性键或极性键 | 极性键 |
| 分子内原子排列 | 对称 | 不对称 |

分子极性的判断方法:
An型分子(以非极性键结合形成的单质分子)一般是非极性分子(O3例外),AB型分子一定是极性分子。对于ABn型分子是极性分子还是非极性分子,通常有以下判断方法。
1.根据分子的立体构型判断
判断ABn型分子是否有极性,关键是看分子的立体构型.如果分子的立体构型为直线形、平面三角形、正四面体形、三角双锥形、正八面体形等空间对称的结构,致使正电中心与负电中心重合,这样的分子就是非极性分子。若为V形、三角锥形、四面体形(非正四面体形)等非对称结构,则为极性分子。比如H2O分子中虽然2个H原子轴对称,但整个分子的空间构型是不对称的: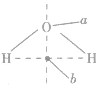 ,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
2.根据实验现象判断
将液体放入适宜的滴定管中,打开活塞让其缓慢流下,将用毛皮摩擦过的橡胶棒靠近液流,流动方向变化(发生偏移)的是极性分子.流动方向不变的是非极性分子。
3.根据中心原子最外层电子是否全部成键判断
ABn型分子中的中心原子A的最外层电子若全部成键(没有孤电子对),此分子一般为非极性分子,如CO2、CCl4等;分子中的中心原子最外层电子若未全部成键(有孤电子对),此分子一般为极性分子,如H2O、 PCl3等。
4.判断ABn型分子极性的经验规律
若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。如BF3、CO2、CH4、SO3等分子中,B、C、S等元素的化合价的绝对值等于其主族序数,是非极性分子;H2O、 NH3、SO2、PCl3等分子中,O、N、S、P等元素的化合价的绝对值不等于其主族序数,是极性分子。
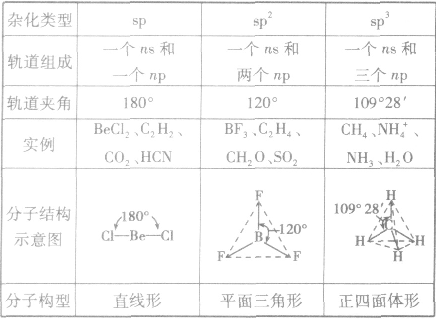
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
晶胞:
1.定义描述晶体结构的基本单元叫做晶胞。
2.结构一般来说,晶胞为平行六面体,晶胞只是晶体微观空间里的一个基本单元,在它的上、下、左、右、前、后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。“无隙”是指相邻晶胞之间没有任何间隙,“并置”是指所有晶胞都是平行排列的,取向相同。
晶胞中微粒数目的确定:
计算晶胞中微粒数目的常用方法是均摊法。均摊法是指每个晶胞平均拥有的粒子数目。如某个粒子为n个晶胞所共有,则该粒子有 属于这个晶胞。
属于这个晶胞。
(1)长方体(或正方体)形晶胞中不同位置的粒子数的计算。
①处于顶点的粒子,同时为8个晶胞所共有,每个粒子有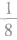 属于该晶胞。
属于该晶胞。
②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有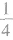 属于该晶胞。
属于该晶胞。
③处于面上的粒子,同时为2个晶胞所共有。每个粒子有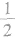 属于该晶胞。
属于该晶胞。
④处于晶胞内部的粒子,则完全属于该晶胞。
(2)非平行六面体形晶胞中粒子数目的计算同样可用均摊法,其关键仍然是确定一个粒子为几个晶胞所共有。例如,石墨晶胞每一层内碳原子排成许多个六边形,其顶点(1个碳原子)对六边形的贡献为 ,那么每一个六边形实际有6×
,那么每一个六边形实际有6× =2个碳原子。
=2个碳原子。
(3)在六棱柱晶胞(如图所示 MgB2的晶胞)中,顶点上的原子为6 个晶胞(同层3个,上层或下层3个) 共有,面上的原子为2个晶胞共有,因此镁原子个数为12×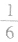 +2×
+2×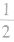 =3,硼原子个数为6。
=3,硼原子个数为6。 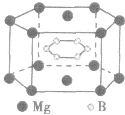
特别提醒:在晶胞中微粒个数的计算过程中,不要形成思维定式,不同形状的晶胞应先分析任意位置上的一个粒子被几个晶胞共用,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心上的原子依次被6、3、4、2 个晶胞共用。
有关晶胞密度的计算步骤:
①根据“分摊法”算出每个晶胞实际含有各类原子的个数,计算出晶胞的质量m:
②根据边长计算晶胞的体积V:
③根据 进行计算,得出结果。
进行计算,得出结果。
等电子原理:
1.等电子原理等电子体具有相似的化学键特征,它们的结构相似,物理性质相近,此原理称为等电子原理。例如,CO和N2的熔沸点、溶解性、分子解离能等都非常相近。
2.等电子粒子电子数相同的粒子(原子、分子、离子)称为等电子粒子。
常见的等电子粒子: 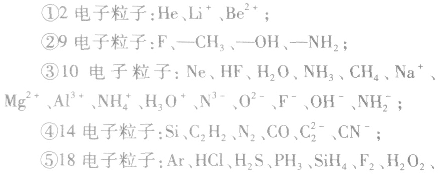
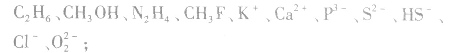
⑥核外电子总数及质子数均相等的粒子: 
3.等电子体
(1)原子总数相同、价电子总数相同的粒子互称为等电子体。如N2与CO是等电子体,但N2与C2H2不是等电子体;O2与SO2是等电子体。
(2)常见的等电子体
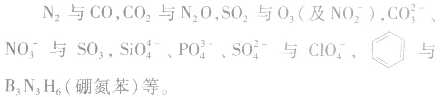
4.等电子原理的应用
(1)利用等电子原理可以较快判断一些分子或离子的构型,如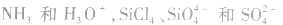 的空间构型分别是三角锥形和正四面体形。
的空间构型分别是三角锥形和正四面体形。
(2)在制造新材料方面有重要应用。如晶体硅、锗是良好的半导体材料,它们的等电子体磷化铝(AIP)、砷化镓(GaAs)也都是良好的半导体材料。,
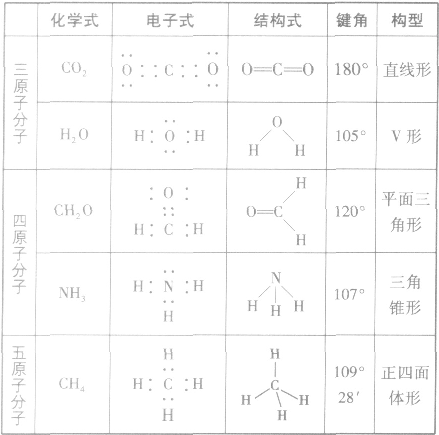
常见分子的立体结构:
与“(1)下表是A、B、C、D、E五种短周期元素的某些性质①A元素是形...”考查相似的试题有:
- NH3.H2S等是极性键构成的极性分子,CO2.BF3.CCl4等是极性键构成的非极性分子。根据上述事实,通过比较归纳可推出ABn型分子...
- 下列物质:①CO2;②CCl4;③NH3;④BF3;⑤H2O;⑥HBr中,分子中电荷的空间分布是对称的是( )A.①②④B.②④⑤C.④⑤D.①②
- 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中下图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正...
- (1)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注.甲醛(CH2O...
- 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。(1)下列叙述正确的是______(填字母)。A.CH2O与水分子间能形成氢键...
- 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。(1)氧原子在基态时,核外电子的轨道...
- 下面有关金属的叙述正确的是A.金属原子只有还原性而其阳离子只有氧化性B.金属阳离子只存于化合物中且有相应的阴离子相配合C...
- [化学—选修物质结构与性质](15分)美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破。石墨烯...
- 某单质其密度为5g/cm3,用X射线研究表明:在棱长为1×10-7cm的立方体中含有20个原子,则此元素的原子相对质量最接近( )A.32...
- 某离子化合物的晶胞如图所示,黑球代表阳离子(A)、白球代表阴离子(B).下列说法错误的是( )A.阳离子配位数为8B.配位...