本试题 “常温下,现有pH=3的某酸HX溶液和pH=11某碱YOH溶液,两溶液混合后,溶液的pH小于7。下表中判断合理的是[ ]HX YOH溶液的体积关系A.强酸 强碱V(HX)=V(YOH)B.强...” 主要考查您对溶液的酸碱性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶液的酸碱性
溶液的酸碱性:
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
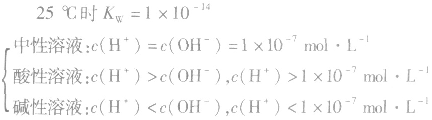
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
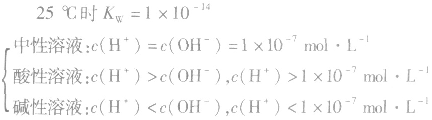
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
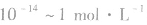 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: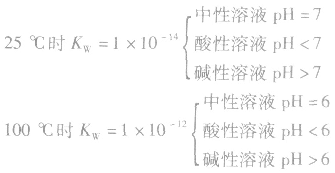
发现相似题
与“常温下,现有pH=3的某酸HX溶液和pH=11某碱YOH溶液,两溶液混...”考查相似的试题有:
- 对酸雨的pH描述中最准确是[ ]A.小于7B.小于5.6C.在5.6~7之间D.等于5.6
- 常温下,下列有关说法正确的是[ ]A.在CH3COONa溶液中,存在c(CH3COO-)+c(CH3COOH) +c(OH-)=2c(Na+)+c(H+)B.某物质的溶液呈...
- 已知水在25℃和95℃时,其电离平衡曲线如图所示(1)则95℃时水的电离平衡曲线应为_________(填“A”或“B”)。(2)25℃时,将pH=...
- 将pH为5的盐酸溶液稀释500倍,稀释后溶液中c(Cl-)和c(H+)之比约为[ ]A.1:2B.1:5C.1:10D.10:1
- 室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是[ ]A.0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液B.0.1mol/L的盐酸...
- 常温时,以下4种溶液pH最小的是[ ]A.0.01mol ·L-1醋酸溶液B.0.02mol ·L-1醋酸与0.02mol ·L-1NaOH溶液等体积混合液C.0.03mo...
- 室温时将pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=11,则强酸与强碱的体积比是[ ]A.11:1B.9:1C.1:11...
- 在25℃时,有pH为a的盐酸和pH为b的NaOH溶液,取VaL该盐酸,同该NaOH溶液中和,需VbL NaOH溶液,填空:(1)若a+b=14,则Va:Vb=...
- (1)某温度(t℃)时,水的Kw=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:①若所得混合液为中性,则...
- 将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液pH的变化是[ ]A.前者减少后者不变B.前者减小后者增大C.都不变...