本试题 “T℃时,N2与H2反应生成NH3,其能量变化如图(I)所示.若保持其他条件不变,温度分别为T1℃和T2℃时,NH3的体积分数与时间的关系如图(II)所示.则下列结论正确...” 主要考查您对焓变、反应热
热化学方程式
化学反应的限度
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 焓变、反应热
- 热化学方程式
- 化学反应的限度
反应热,焓变:
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
热化学方程式:
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如: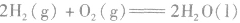 :
: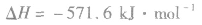 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如:
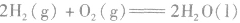 :
: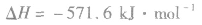 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
化学反应的限度:
研究可逆反应所能达到的最大程度。也就是化学平衡状态。
达到反应限度的判断:
(1)v正=v逆
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的、前后化学计量数改变的可逆反应,压强、平均相对分子量保持不变。
(4)对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
(5)对于同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
研究可逆反应所能达到的最大程度。也就是化学平衡状态。
达到反应限度的判断:
(1)v正=v逆
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的、前后化学计量数改变的可逆反应,压强、平均相对分子量保持不变。
(4)对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
(5)对于同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
发现相似题
与“T℃时,N2与H2反应生成NH3,其能量变化如图(I)所示.若保持...”考查相似的试题有:
- 管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为:2H2(g)+O2(g)==2H2O(l)ΔH="-571.6" kJ/mol2CO(...
- 当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则下列热化学方程式正确的是①N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ...
- 关于化学反应与能量的说法正确的是( )A.中和反应是吸热反应B.燃烧属于吸热反应C.反应物总能量与生成物总能量一定相等D....
- 在298 K、100 kPa时,已知:2H2O(g)2H2(g)+O2(g) ΔH1Cl2(g)+H2(g)2HCl(g) ΔH22Cl2+2H2O(g)4HCl(g)+O2(g) ΔH3则ΔH3与ΔH2和ΔH1...
- 下列说法:①同种元素的原子构成的微粒性质相同;②“冰,水为之,而寒于水.”说明相同质量的水和冰,水的能量高;③能自发发生的...
- 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H="-57.3" kJ/mol,下列说法中正确的是 ( )A.浓硫酸和NaOH溶液反应,生成 l mol...
- T℃时,N2与H2反应生成NH3,其能量变化如图(I)所示.若保持其他条件不变,温度分别为T1℃和T2℃时,NH3的体积分数与时间的关系...
- 2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷...
- 下列方程式中,正确的是[ ]A.碳酸氢钠在水中的电离方程式:NaHCO3==Na++H++CO32-B.铁屑与稀硫酸反应的离子方程式:Fe+2H+==...
- 将化学知识系统化,有助于对化学问题的进一步认识和理解。资料1:化学反应的碰撞理论:反应物分子间的相互碰撞是反应进行的必...