本试题 “如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB= aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)2Z(g)+W(g) ...” 主要考查您对影响化学反应速率的因素
达到化学平衡的标志
化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 影响化学反应速率的因素
- 达到化学平衡的标志
- 化学平衡的有关计算
影响化学反应速率的因素:
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为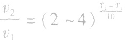
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释
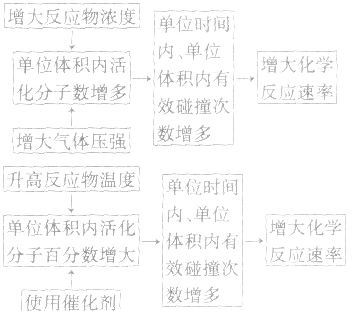
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
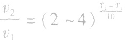
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释

化学平衡移动的含义:
1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,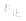 >
>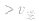 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动;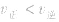 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。
化学平衡状态:
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
化学平衡的特征:
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等: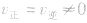 。
。
(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使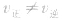 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
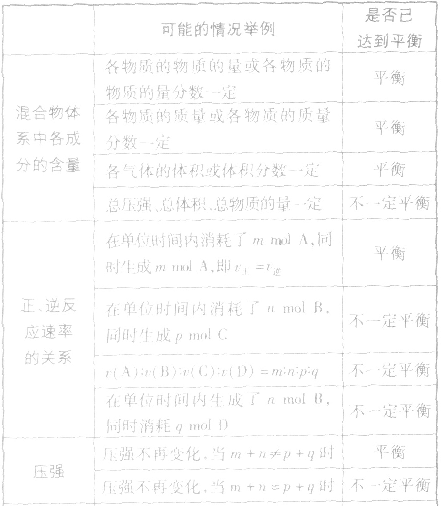
化学平衡状态的判断:
1.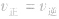 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。
2.反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变。
3.反应类型分析对于密闭容器中的反应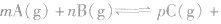 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。

1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,
 >
>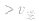 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动;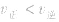 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。化学平衡状态:
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到
 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。 化学平衡的特征:
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等:
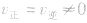 。
。(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使
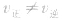 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。化学平衡状态的判断:
1.
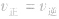 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。 2.反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变。
3.反应类型分析对于密闭容器中的反应
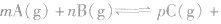 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。

化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
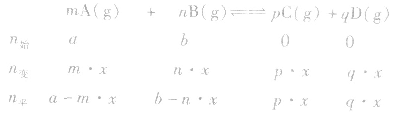
则有:

(2)对于反应物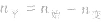 ,对于生成物
,对于生成物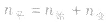
(3)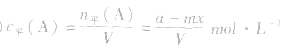
(4)A的转化率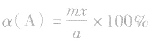
(5)平衡时A的体积(物质的量)分数
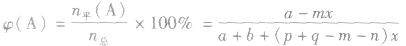
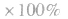
(6)
(7)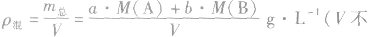
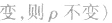
(8)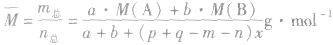
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
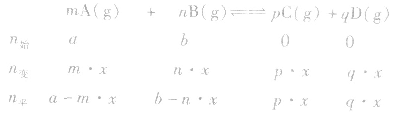
则有:

(2)对于反应物
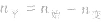 ,对于生成物
,对于生成物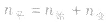
(3)
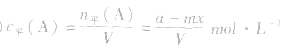
(4)A的转化率
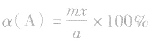
(5)平衡时A的体积(物质的量)分数
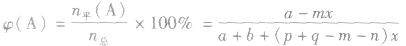
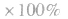
(6)

(7)
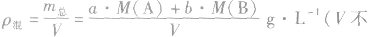
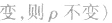
(8)
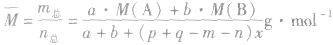
发现相似题
与“如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,...”考查相似的试题有:
- 在密闭容器中进行N2+3H22NH3反应,起始时N2和H2分别为10mol和30mol,当达到平衡时N2的转化率为30%。若以NH3作为起始反应物,...
- 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:...
- 反应A(g)+B(s)C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:(填增大,减小或不变) (1) 升温___ ; (2...
- 在一定条件下,发生如下反应:;(1)该反应中的含义是(填序号):___________。①该反应达到平衡时放出的热量②该反应达到平衡...
- 在℃时反应2A(g)B(g);△H达到平衡时混合气体平均分子量(数值上等于混合气体的总质量除以总物质的量)为,℃时该反应平衡混合气...
- “低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济...
- 将除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生H2的速率变化情况如下图所示。图中t1~t2速率变化的主要原因是____...
- 向新制备的氯水中不断滴入饱和NaCl溶液,则下列曲线符合氯水pH变化的是( )
- 已知反应:N2(g)+3H2(g)2NH3(g)△H<0,向某体积恒定的密闭容器中按体积比1﹕3充入N2和 H2,在一定条件下发生反应,下图...
- (8分)Ⅰ、A和B反应生成C,假定反应刚开始只有A、B,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为...