本试题 “(6分)KMnO4溶液与H2C2O4溶液可发生如下反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O(1)该反应速率开始十分缓慢,一段时间后突然加快,这是因为__...” 主要考查您对水的离子积常数
水电离的影响因素
水的电离平衡
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水的离子积常数
- 水电离的影响因素
- 水的电离平衡
水的电离:
水是一种极弱的电解质,它能微弱地电离:
实验测得:25℃时,1L纯水中只有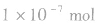 的水分子发生电离,故25℃时纯水中
的水分子发生电离,故25℃时纯水中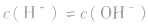

水的离子积:
在一定温度下,水电离出的c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积,用符号 表示,即
表示,即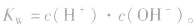
(1)在一定温度下,水的离子积都是一个常数,在25℃时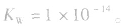
(2)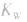 随温度的变化而变化,温度升高,
随温度的变化而变化,温度升高,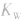 增大。
增大。
(3)水的离子积常数揭示了在任何水溶液中均存在水的电离平衡,都有 存在。在酸性或碱性的稀溶液中,当温度为25℃时,
存在。在酸性或碱性的稀溶液中,当温度为25℃时,
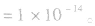
(4)在酸或碱的稀溶液中,由水电离出的c(H+)和c(OH-)总相等.即 如25℃时
如25℃时 或NaOH溶液中,
或NaOH溶液中,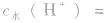
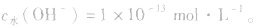
溶液中c(H+)或c(OH-)的计算:
常温下,稀溶液中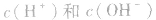 的乘积总是
的乘积总是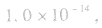 知道
知道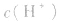 就可以计算出
就可以计算出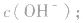 反之亦然
反之亦然
1.酸溶液
当在水中加入酸后,将使水的电离平衡向左移动 (抑制水的电离)。在酸的水溶液中,H+主要由酸电离产生,即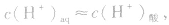 而OH-是由水电离产生的:
而OH-是由水电离产生的: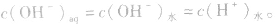
2.碱溶液
同理,在碱的水溶液中,OH-主要由碱电离产生,即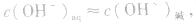 而H+是由水电离产生的:
而H+是由水电离产生的: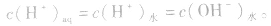
3.盐溶液
在盐的水溶液中,H+和OH-全部来自水的电离,且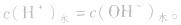
(1)若单一水解的盐的水溶液呈酸性,c(H+)> c(OH-),即弱碱阳离子水解


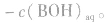
(2)若单一水解的盐的水溶液呈碱性,c(OH一)> c(H+),即弱酸阴离子水解
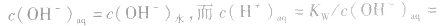
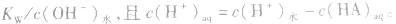
说明:由以上分析可以看出,在常温下(25℃):
酸(或碱)的溶液中,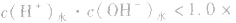
 发生水解的盐溶液中
发生水解的盐溶液中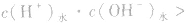
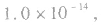 但
但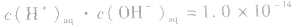 总成立。
总成立。
影响水电离平衡的因素:
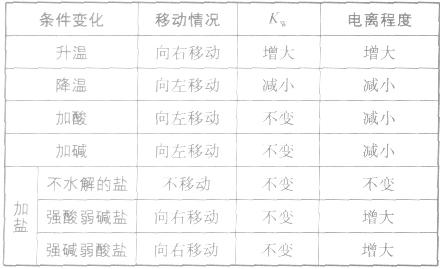
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
发现相似题
与“(6分)KMnO4溶液与H2C2O4溶液可发生如下反应:2KMnO4+5H2C2O4+...”考查相似的试题有:
- 设NA是阿伏加德罗常数的数值,下列说法正确的是A.1molAl3+离子含有的核外电子数为3NAB.1molCl2与足量的铁反应,转移的电子...
- 下列溶液一定呈中性的是( )A.c(H+)=10-7mol/L的溶液B.pH=7的溶液C.c(H+)/c(OH-)=10-14的溶液D.氨水与氯化铵的混合液中c...
- 常温下,用 0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得滴定曲线如图。下列说法正确的是A.点①所...
- 在t℃时,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得...
- W、X、Y、Z是原子序数依次增大的四种短周期元素,化合物WX能抑制水的电离,离子化合物Y2Z能捉进水的电离。则Y元素是A.LiB.F...
- 将 a g 含NaOH样品溶解在 b mL 0.l mol·L-1的硫酸中,再加入 c mL 0.1 mol·L-1的氢氧化钡溶液,反应后所得溶液恰好呈中性,...
- 现有常温下A、B、C、D、E五种盐溶液,分别由K+、NH4+、Ag+、Ba2+、Al3+、Cl-、Br-、CO32-、SO42-、NO3-中的阳离子和阴离子各...
- 室温下,0.1mol·L-1某一元弱碱(AOH)溶液中c(OH-)/c(H+)=1.0×108,下列叙述不正确的是A.该一元碱溶液的pH=11B.该溶液...
- 下列各组物质在溶液中的反应,可用同一离子方程式表示的是A.Cu(OH)2和盐酸、Cu(OH)2和醋酸B.BaCl2和Na2SO4、Ba(OH)2和(NH4)...
- 能促进水的电离,并使溶液中的c(H+)>c(OH-)的操作是( )①将水加热煮沸②向水中投入一小块金属钠③向水中通CO2④向水中加入...