本试题 “根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题.元素代号I1I2I3I4Q2080400061009400R500460069009500S7401500770010500T5801800270011600U420...” 主要考查您对电负性
物质性质的研究
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电负性
- 物质性质的研究
电负性:
(1)键合电子、电负性的定义
元素相互化合时,原子中用于形成化学键的电子称为键合电子。电负性用来描述不同元素的原子对键合电子吸引力的大小。
(2)电负性的意义:电负性越大的原子,对键合电子的吸引力越大。
(3)电负性大小的标准:以氟的电负性为4.0作为相对标准。
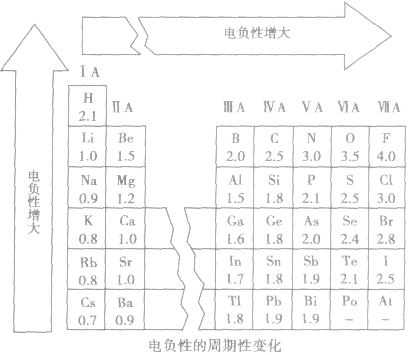
(4)电负性的变化规律
①随原子序数的递增,元素的电负性呈周期性变化。
②同周期,从左到右,元素的电负性逐渐变大。
③同主族,从上到下,元素的电负性逐渐变小。
电负性的应用:
①判断元素的金属性和非金属性的强弱
金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②判断元素化合价的正负
利用电负性可以判断化合物中元素化合价的正负:电负性大的元素易呈现负价,电负性小的元素易呈现正价。
③判断化学键的类型
一般认为,如果成键原子所属元素的电负性差值大于 1.7,它们之间通常形成离子键;如果成键原子所属元素的电负性差值小于1.7,它们之间通常形成共价键。
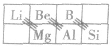
④解释“对角线规则”
在元素周期表中,某些主族元素与其右下方的主族元素(如右图所示)的有些性质是相似的,被称为“对角线规则”。例如:硼和硅的含氧酸盐都能形成玻璃且互熔,含氧酸都是弱酸等。
研究对象:
物质的物理性质、化学性质物质性质。
研究方法:
观察与问题、假设与预测、实验与事实、解释与结论、表达与交流、扩展与迁移。
发现相似题
与“根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各...”考查相似的试题有:
- 根据下列五种元素的电离能数据(单位:kJ/mol),判断下列说法不正确的是[ ]A.元素的电负性最大的可能是Q元素B.R和S均可能与U...
- 某元素X的逐级电离能如图所示,下列说法正确的是( )A.X元素显+4价B.X为非金属C.X为第五周期元素D.X与氯反应时最可能生...
- [化学选修3:物质结构与性质]Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:①Q为元素周期表中原子半径最小的...
- 已知锂和镁在元素周期表中有特殊“对角线”关系,它们的性质非常相似.下列有关锂及其化合物叙述正确的是( )A.Li2SO4难溶于...
- 几种常见晶体的物理性质见下表,请完成表中空格晶 体氯化钠氯化钡金刚石二氧化硅硫白磷钠钨熔点 0C801156035501723112.844.19...
- 下列各组物质中,互为同位素的是 ( ) A.氕、氚B.氧气、臭氧C.红磷、白磷D.冰、水
- 现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D原子核外哑铃形原子轨道上有2个未成对电子,D与A形成的...
- 下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白: 主族周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0族2①②③3④⑤⑥⑦⑧4⑨(1)碱性最强的化...
- 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发...
- 【物质结构与性质】天冬酰胺(结构如右图)在芦笋中含量丰富,具有提高身体免疫力的功效。(1)天冬酰胺所含元素中 (填元素...