本试题 “如图是某兴趣小组设计的四个实验装置,其中实验操作设计正确的是( )A.稀释浓硫酸B.探究可燃物燃烧的条件C.称量氯化钠D.验证质量守恒定律” 主要考查您对称量器—天平
浓硫酸的稀释
验证质量守恒定律
验证物质燃烧的条件
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 称量器—天平
- 浓硫酸的稀释
- 验证质量守恒定律
- 验证物质燃烧的条件
定义:
天平是用于称量物体质量,狭义上也叫托盘天平(实验室中多用托盘天平)。
常用的精确度不高的天平,由托盘、指针、横梁、标尺、游码、砝码、平衡螺母、分度盘等组成。分度值一般为0.1或0.2克。
一种衡器:由支点(轴)在梁的中心支着天平梁而形成两个臂每个臂上挂着一个盘,其中一个盘里放着已知重量的物体另一个盘里放待称重的物体,固定在梁上的指针在不摆动且指向正中刻度时的偏转就指示出待称重物体的重量。

托盘天平的使用方法:
(1)要放置在水平的地方。游码要归零。
(2)调节平衡螺母(天平两端的螺母)调节零点直至指针对准中央刻度线。
(3)左托盘放称量物,右托盘放砝码(左物右码)。根据称量物的性状应放在玻璃器皿或洁净的纸上,事先应在同一天平上称得玻璃器皿或纸片的质量,然后称量待称物质。
(4)添加砝码从估计称量物的最大值加起,逐步减小。托盘天平只能称准到0.1克。加减砝码并移动标尺上的游码,直至指针再次对准中央刻度线。
(5)过冷过热的物体不可放在天平上称量。应先在干燥器内放置至室温后再称(或在特殊器皿中称量)。
(6)物体的质量=砝码重量+游码所显示的度数
(7)取用砝码必须用镊子轻拿轻放,取下的砝码应放在砝码盒中,称量完毕,应把游码移回零点。
(8)称量干燥的固体药品时,应在两个托盘上各放一张相同质量的纸,然后把药品放在纸上称量。
(9)易潮解的药品,必须放在玻璃器皿上(如:小烧杯、表面皿)里称量。
(10)砝码若生锈,测量结果偏小;砝码若磨损,测量结果偏大。
解题技巧:
1、定物称量:是指对某一物质,用托盘天平称量其质量,例如要称出一铁块的质量。
方法:
①先将游码归零,再调节托盘天平左、右的平衡螺母,至平衡。
②在左盘上放铁块。
③向右盘添加砝码,先加质量大的砝码,再加质量小的砝码,最后移动游码,直至天平平衡。砝码和游码的示数和即为铁块的质量。
2、定量称量:是指用托盘天平称量出一定质量的某物质。例如要称量5.5gNaCl。
方法:
①调节托盘天平平衡螺母至天平平衡。
②在左、右两盘各放一张质量相同的纸。
③向右盘添加5g砝码,再移动游码至0.5g处。
④向左盘不断地加入NaCl.
天平的分类:
有狭义和广义之分。
狭义的天平专指双盘等臂机械天平,是利用等臂杠杆平衡原理,将被测物与相应砝码比较衡量,从而确定被测物质量的一种衡器。
广义的天平则包括双盘等臂机械天平、单盘不等臂机械天平和电子天平3类。
双盘等臂机械天平,一般按结构分为普通标牌天平、微分标牌天平和架盘天平3种。
也可按用途分为检定天平、分析天平、精密天平和普通天平4种。
①检定天平:是计量部门、商检部门或其他有关部门或工厂专门用来检查或校准砝码的天平。
②分析天平:是用于化学分析和物质精确衡量的高准确度天平。在大多数情况下,这类天平的最小分度值都小于最大称量的 10-5。分析天平可按衡量范围和最小分度值分为常量天平(称量和最小分度值分别为100~200g和0.01~1mg)、半微量天平(30~100g和1~10g)、微量天平(3~30g和0.1~1g)和超微量天平(3~5g和0.1g以下)。
③精密天平:广泛应用于各种物质的精密衡量,其最小分度值通常为最大称量的10-5~10-4。
④普通天平:用作物质的一般衡量。最小分度值等于或大于最大称量的10-4。
浓硫酸:
俗称坏水。坏水指浓度大于或等于70%的硫酸溶液。浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。同时它还具有脱水性,强氧化性,难挥发性,酸性,稳定性,吸水性等。
浓硫酸的稀释:
稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中,因为水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾。使硫酸液滴向四周飞溅,这是非常危险的(如下图)。若不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%一5%的 NaHCO3溶液。
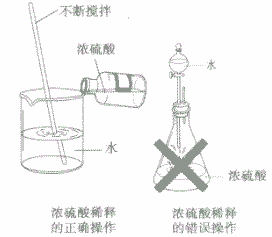
切记“酸入水,沿器壁,慢慢倒,不断搅”。注酸入水不断搅拌
俗称坏水。坏水指浓度大于或等于70%的硫酸溶液。浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。同时它还具有脱水性,强氧化性,难挥发性,酸性,稳定性,吸水性等。
浓硫酸的稀释:
稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中,因为水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾。使硫酸液滴向四周飞溅,这是非常危险的(如下图)。若不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%一5%的 NaHCO3溶液。

切记“酸入水,沿器壁,慢慢倒,不断搅”。注酸入水不断搅拌
验证质量守恒定律:
通过研究体系体积的变化对探究质量守恒定律的影响,增强学生对质量守恒定律的理解,从而养成实事求是、勇于探索的科学态度。
质量守值定律的实验探究:
(1)实验装置
①无气态物质参加或生成的反应可在敞口装置中进行,如Fe+CuSO4==FeSO4+Cu
②有气态物质参加或生成的反应,应在密闭容器中进行,如白磷燃烧,NaOH与CO2反应,Zn与稀硫酸反应等。
③为确保实验成功,有时在装置上系一个气球来保证装置的密闭。如白磷燃烧实验,但也要考虑气球最终不能恢复原状,则装置在空气中受到的浮力会改变,装置对天平托盘的压力会改变,影响对质量守恒定律的探究。
(2)实验方案及结论
通过研究体系体积的变化对探究质量守恒定律的影响,增强学生对质量守恒定律的理解,从而养成实事求是、勇于探索的科学态度。
质量守值定律的实验探究:
(1)实验装置
①无气态物质参加或生成的反应可在敞口装置中进行,如Fe+CuSO4==FeSO4+Cu
②有气态物质参加或生成的反应,应在密闭容器中进行,如白磷燃烧,NaOH与CO2反应,Zn与稀硫酸反应等。
③为确保实验成功,有时在装置上系一个气球来保证装置的密闭。如白磷燃烧实验,但也要考虑气球最终不能恢复原状,则装置在空气中受到的浮力会改变,装置对天平托盘的压力会改变,影响对质量守恒定律的探究。
(2)实验方案及结论
| 方案一 | 方案二 | |
| 实验现象 | 白磷燃烧,产生大量白烟,放出热量,天平平衡 | 铁钉表面覆盖一层红色物质,溶液由蓝色逐渐变为浅绿色,天平平衡 |
| 反应前总质量 | m1 | m1 |
| 反应后总质量 | m2 | m2 |
| 反应前后总质量的关系 | m1=m2 | m1=m2 |
| 分析 | 磷+氧气 五氧化二磷 五氧化二磷容器密闭,物质没有进入或散失 |
铁+硫酸铜→铜+硫酸亚铁 反应无气体参加,无气体生成,没有物质从烧杯中散失 |
| 结论 | 分析比较两个方案的实验结果,可以发现反应前后物质的质量总和不变 | |
定义:
燃烧是一种发光、发热的剧烈的化学反应。认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的。
燃烧条件的探究实验:
1. 实验方案
2. 实验结论:
燃烧必须同时具备:
①可燃物
②氧气(空气)
③达到燃烧所需的最低温度(着火点)
1. 着火点:可燃物燃烧所需的最低温度叫着火点,是物质固有的一种性质,与物质本身的性质有关,一般不随外界条件的改变而改变。
在通常状况下一些常见物质的着火点
2. 探究燃烧条件的实验设计方法
燃烧必须同时具备: ①可燃物 ②氧气(空气) ③达到燃烧所需的最低温度(着火点)。中考试题往往以实验设计题的形式来考查燃烧规律。燃烧条件的探究设计常常运用控制变量—对比法。
(1)分析对比实验设计

实验1:探究可燃物才能燃烧
实验2:探究可燃物接触氧气才能燃烧
实验3:探究达到着火点可燃物才能燃烧
(2)综合控制变量
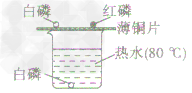
①把白磷和红磷都漏置在空气中(对比),用0℃的热水控制温度(这个温度高于白磷的着火点,低于红磷的着火点),白磷能燃烧,红磷不能燃烧,证明可燃物与氧气接触,且可燃物还必须达到着火点才能燃烧。
②烧杯底部放一块白磷,用水控制不让白磷与空气接触,温度仍然是80℃,与铜片上的白磷对比,证明可燃物即使温度达到着火点,如果不与氧气接触也不能燃烧。
燃烧是一种发光、发热的剧烈的化学反应。认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的。
燃烧条件的探究实验:
1. 实验方案
| 实验方案 | 实验现象 | 分析 |
分别将一小块白磷和一小块红磷放在薄铜片上,另取一小块白磷放入热水中,如下图: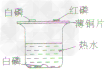 |
①薄铜片上:白磷燃烧,产生大量白烟,红磷没有变化 ②热水中,白磷没有燃烧 |
①白磷、红磷都是可燃物.薄铜片上的白磷与O2接触,同时温度达到白磷的着火点,故白磷能够燃烧 ②薄铜片上的红磷与O2 接触,但温度没有达到其着火点,热水中的白磷温度达到了其着火点.但没有与O2接触,所以红磷和水中的白磷都不能燃烧 |
2. 实验结论:
燃烧必须同时具备:
①可燃物
②氧气(空气)
③达到燃烧所需的最低温度(着火点)
1. 着火点:可燃物燃烧所需的最低温度叫着火点,是物质固有的一种性质,与物质本身的性质有关,一般不随外界条件的改变而改变。
在通常状况下一些常见物质的着火点
| 物质 | 白磷 | 红磷 | 木材 | 木炭 | 无烟煤 |
| 着火点/℃ | 40 | 240 | 250-330 | 320-370 | 700-750 |
燃烧必须同时具备: ①可燃物 ②氧气(空气) ③达到燃烧所需的最低温度(着火点)。中考试题往往以实验设计题的形式来考查燃烧规律。燃烧条件的探究设计常常运用控制变量—对比法。
(1)分析对比实验设计

实验1:探究可燃物才能燃烧
实验2:探究可燃物接触氧气才能燃烧
实验3:探究达到着火点可燃物才能燃烧
(2)综合控制变量

①把白磷和红磷都漏置在空气中(对比),用0℃的热水控制温度(这个温度高于白磷的着火点,低于红磷的着火点),白磷能燃烧,红磷不能燃烧,证明可燃物与氧气接触,且可燃物还必须达到着火点才能燃烧。
②烧杯底部放一块白磷,用水控制不让白磷与空气接触,温度仍然是80℃,与铜片上的白磷对比,证明可燃物即使温度达到着火点,如果不与氧气接触也不能燃烧。
发现相似题
与“如图是某兴趣小组设计的四个实验装置,其中实验操作设计正确...”考查相似的试题有:
- 下列图示实验操作中,错误的是
- 下列实验基本操作正确的是( )A.稀释浓硫酸B.称量氢氧化钠固体C.闻气体气味D.取用碳酸钠粉末
- 下列实验基本操作正确的是 A.取用固体B.点燃酒精灯C.溶解固体D.过滤
- 下列装置操作图不能用于检查气密性的是( )
- 以下化学药品保存或实验操作正确的是
- 粗盐提纯中,蒸发时不需要用到的仪器是
- 正确的化学实验操作对实验结果、人身安全都非常重要,如图所示的实验操作中,正确的是( )A.铁丝在氧气中燃烧B.熄灭酒精灯...
- 小新用在空气中燃烧镁带的实验来探究质量守恒定律:(1)镁带燃烧的化学方程式为____ _____.(2)完全燃烧后,称量留下固体的质...
- 某研究性学习小组为验证质量守恒定律,设计了下图所示的装置(放在石棉网上的仪器是玻璃钟罩)进行实验。下列说法不正确的是[...
- 2013年4月25日晚8点,台州市的一金属堆场发生火灾,十多吨金属镁发生爆燃后发出刺眼的白光,将夜空映照得如同白昼,消防指挥...