本试题 “在K2Cr2O7溶液中存在如下平衡:Cr2O72-+ H2O2CrO42-+ 2H+。向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是[ ]A.加入X溶液,上述平...” 主要考查您对盐水解的影响因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盐水解的影响因素
影响盐类水解平衡的因素:
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对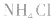 水解平衡
水解平衡
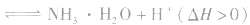 的影响
的影响
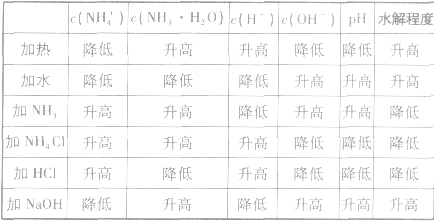
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
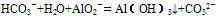
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对
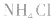 水解平衡
水解平衡
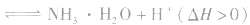 的影响
的影响
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
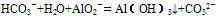
盐类水解程度大小比较规律:
1.盐水解生成的弱酸(或弱碱)越弱,水解程度越大。常据此判断弱酸(或弱碱)的相对强弱:如等浓度的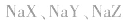 三种盐溶液,pH依次增大,则弱酸根离子
三种盐溶液,pH依次增大,则弱酸根离子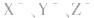 的水解程度依次增大,所以酸性HX>HY>HZ。
的水解程度依次增大,所以酸性HX>HY>HZ。
2.相同条件下:正盐>相应酸式盐。如水解程度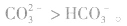
3.相互促进水解的盐>单水解的盐>相互抑制水解的盐。如水解程度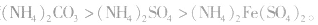
发现相似题
与“在K2Cr2O7溶液中存在如下平衡:Cr2O72-+ H2O2CrO42-+ 2H+。向...”考查相似的试题有:
- 下列叙述正确的是A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]...
- 等体积的下列溶液中,阳离子总数最多的是()A.0.1mol·L-1的FeCl3溶液B.0.1mol·L-1的AlCl3溶液C.0.05mol·L-1的Na2S溶液D....
- 下列离子方程式正确的是( )A.Na2CO3溶液的水解+2H2OH2CO3+2OH-B.金属铝溶于氢氧化钠溶液 Al+2OH-+H2↑C.铜与浓硝酸反应 3Cu...
- 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性...
- 在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示。图中①②③可能是( )A.NH4NO3、(NH4)2SO...
- FeCl3的水解方程式可写为FeCl3+3H2OFe(OH)3+3HCl,若提高水解程度采取的方法是 ( )A.降低温度B.加入少量Na2CO3C.加入少量...
- (6分)(用化学用语及必要的文字回答)(1) 配制碳酸钾溶液要加少量的__ ___,原因是____ 。 (2)FeCl3溶液蒸干并灼烧得到...
- 下列根据反应原理设计的应用,不正确的是A.CO32-+H2OHCO3-+OH- 热的纯碱溶液清洗油污B.Al3++3H2OAl(OH)3(胶体)+3H+...
- 物质的量浓度都为0.1 mol·L-1的CH3COOH与NaOH溶液等体积混合后,下列关系式不正确的是A.c(Na+)>c(CH3COO-)>c(H+)>c(OH...
- 等物质的量浓度的下列四种溶液中,浓度最大的是( )A.NH4ClB.NH4HCO3C.NH4NO3D.NH4HSO4