本试题 “下列说法正确的是( )A.第二周期元素的第一电离能随原子序数递增依次增大B.卤族元素中氟的电负性最大C.CO2、SO2都是直线型的非极性分子D.CH2=CH2分子中...” 主要考查您对极性分子、非极性分子
电负性
共价键
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 极性分子、非极性分子
- 电负性
- 共价键
(1)极性分子:正电荷中心和负电荷中心不相重合的分子
(2)非极性分子:正电荷中心和负电荷中心相重合的分子
(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定
非极性分子和极性分子的比较:
| 非极性分子 | 极性分子 | |
| 形成原因 | 整个分子的电荷分布均匀,对称 | 整个分子的电荷分布不均匀、不对称 |
| 存在的共价键 | 非极性键或极性键 | 极性键 |
| 分子内原子排列 | 对称 | 不对称 |

分子极性的判断方法:
An型分子(以非极性键结合形成的单质分子)一般是非极性分子(O3例外),AB型分子一定是极性分子。对于ABn型分子是极性分子还是非极性分子,通常有以下判断方法。
1.根据分子的立体构型判断
判断ABn型分子是否有极性,关键是看分子的立体构型.如果分子的立体构型为直线形、平面三角形、正四面体形、三角双锥形、正八面体形等空间对称的结构,致使正电中心与负电中心重合,这样的分子就是非极性分子。若为V形、三角锥形、四面体形(非正四面体形)等非对称结构,则为极性分子。比如H2O分子中虽然2个H原子轴对称,但整个分子的空间构型是不对称的: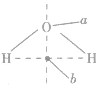 ,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
2.根据实验现象判断
将液体放入适宜的滴定管中,打开活塞让其缓慢流下,将用毛皮摩擦过的橡胶棒靠近液流,流动方向变化(发生偏移)的是极性分子.流动方向不变的是非极性分子。
3.根据中心原子最外层电子是否全部成键判断
ABn型分子中的中心原子A的最外层电子若全部成键(没有孤电子对),此分子一般为非极性分子,如CO2、CCl4等;分子中的中心原子最外层电子若未全部成键(有孤电子对),此分子一般为极性分子,如H2O、 PCl3等。
4.判断ABn型分子极性的经验规律
若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。如BF3、CO2、CH4、SO3等分子中,B、C、S等元素的化合价的绝对值等于其主族序数,是非极性分子;H2O、 NH3、SO2、PCl3等分子中,O、N、S、P等元素的化合价的绝对值不等于其主族序数,是极性分子。
电负性:
(1)键合电子、电负性的定义
元素相互化合时,原子中用于形成化学键的电子称为键合电子。电负性用来描述不同元素的原子对键合电子吸引力的大小。
(2)电负性的意义:电负性越大的原子,对键合电子的吸引力越大。
(3)电负性大小的标准:以氟的电负性为4.0作为相对标准。
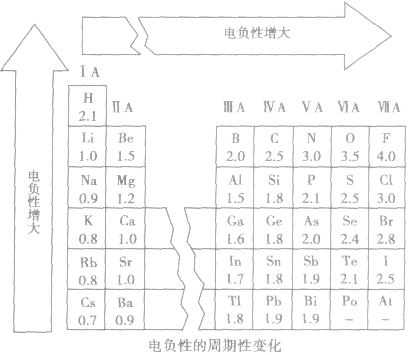
(4)电负性的变化规律
①随原子序数的递增,元素的电负性呈周期性变化。
②同周期,从左到右,元素的电负性逐渐变大。
③同主族,从上到下,元素的电负性逐渐变小。
电负性的应用:
①判断元素的金属性和非金属性的强弱
金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②判断元素化合价的正负
利用电负性可以判断化合物中元素化合价的正负:电负性大的元素易呈现负价,电负性小的元素易呈现正价。
③判断化学键的类型
一般认为,如果成键原子所属元素的电负性差值大于 1.7,它们之间通常形成离子键;如果成键原子所属元素的电负性差值小于1.7,它们之间通常形成共价键。
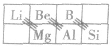
④解释“对角线规则”
在元素周期表中,某些主族元素与其右下方的主族元素(如右图所示)的有些性质是相似的,被称为“对角线规则”。例如:硼和硅的含氧酸盐都能形成玻璃且互熔,含氧酸都是弱酸等。
共价键:
1.本质原子之间形成共用电子对(或电子云重叠),使得电子出现在核间的概率增大。
2.特征
具有方向性与饱和性。
(1)共价键的饱和性一个原子中的一个未成对电子与另一个原子中的一个未成对电子配对成键后,一般来说就不能再与其他原子的未成对电子配对成键了,即每个原子所能形成共价键的总数或以单键连接的原子数目是一定的,这称为共价键的饱和性。
例如,氯原子中只有一个未成对电子,所以两个氯原子之间可以形成一个共价键,结合成氯分子,表示为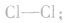 氮原子中有三个未成对电子,两个氮原子之间能够以共价三键结合成氮分子,表示为
氮原子中有三个未成对电子,两个氮原子之间能够以共价三键结合成氮分子,表示为 一个氮原子也可与_二个氢原子以三个共价键结合成氨分子,表示为
一个氮原子也可与_二个氢原子以三个共价键结合成氨分子,表示为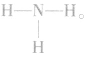
(2)共价键的方向性
共价键将尽可能沿着电子出现概率最大的方向形成,这就是共价键的方向性。除s轨道是球形对称外,其他原子轨道都具有一定的空间分布。在形成共价键时,原子轨道重叠得越多,电子在核间出现的概率越大,所形成的共价键就越牢固。
例如,硫原子的价电子排布是 有两个未成对电子,如果它们分布在互相垂直的
有两个未成对电子,如果它们分布在互相垂直的 轨道中,那么当硫原子和氢原子结合生成硫化氢分子时,一个氢原子的1s轨道上的电子能与硫原子的
轨道中,那么当硫原子和氢原子结合生成硫化氢分子时,一个氢原子的1s轨道上的电子能与硫原子的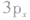 轨道上的电子配对成键,另一个氢原子的1s轨道上的电子只能与硫原子的
轨道上的电子配对成键,另一个氢原子的1s轨道上的电子只能与硫原子的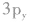 轨道上的电子配对成键。
轨道上的电子配对成键。
说明:
①共价键的饱和性决定着各种原子形成分子时相互结合的数量关系。如一个氢分子只能由两个氢原子构成,一个水分子只能由两个氢原子和一个氧原子构成。
②共价键的方向性决定着分子的空间构型。
3.分类
(1)按成键原子是否相同或共用电子对是否偏移分 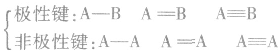
(2)按成键方式分

(3)按共用电子对数分
离子键和共价键:
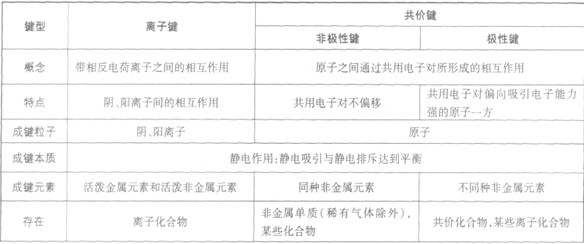

与“下列说法正确的是( )A.第二周期元素的第一电离能随原子序...”考查相似的试题有:
- 经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键...
- 以碳原子为中心与两个氯原子及两个碘原子相结合形成CCl2I2分子,以下判断正确的是:A、CCl2I2分子是非极性分子 B、CCl2I2分子...
- 白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为: P—P a kJ·mol-1、P—O b kJ·mol-1...
- 氮是地球上极为丰富的元素。(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为___________。(2)根据等电子原理,CO与N2互...
- 下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层...
- 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。(1)下列叙述正确的是______(填字母)。A.CH2O与水分子间能形成氢键...
- 下列微粒不存在未成键的孤对电子的是[ ]A.OH-B.NH3C.CH4D.HCl
- 下列叙述正确的是[ ]A.蛋白质、人造纤维和光导纤维都属于有机高分子化合物B.化学反应的过程可以看做是储存在物质内部的能量...
- 下列各组物质熔化或气化时,所克服的粒子间作用属于同种类型的是[ ]A.C60和SiO2熔化B.Mg和S熔化C.氯酸钾和蔗糖熔化D.碘和...
- 下列说法中正确的是( )A.共价化合物中一定不含有离子键,离子化合物中可能含有共价键B.一定条件下1molN2与3molH2在密闭容...