本试题 “(12分)A、B、C、D、E五种均为短周期元素,原子序数依次增大。A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成化合物X’X可以使溴水褪色。A元...” 主要考查您对极性分子、非极性分子
无机分子的立体结构
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 极性分子、非极性分子
- 无机分子的立体结构
(1)极性分子:正电荷中心和负电荷中心不相重合的分子
(2)非极性分子:正电荷中心和负电荷中心相重合的分子
(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定
非极性分子和极性分子的比较:
| 非极性分子 | 极性分子 | |
| 形成原因 | 整个分子的电荷分布均匀,对称 | 整个分子的电荷分布不均匀、不对称 |
| 存在的共价键 | 非极性键或极性键 | 极性键 |
| 分子内原子排列 | 对称 | 不对称 |

分子极性的判断方法:
An型分子(以非极性键结合形成的单质分子)一般是非极性分子(O3例外),AB型分子一定是极性分子。对于ABn型分子是极性分子还是非极性分子,通常有以下判断方法。
1.根据分子的立体构型判断
判断ABn型分子是否有极性,关键是看分子的立体构型.如果分子的立体构型为直线形、平面三角形、正四面体形、三角双锥形、正八面体形等空间对称的结构,致使正电中心与负电中心重合,这样的分子就是非极性分子。若为V形、三角锥形、四面体形(非正四面体形)等非对称结构,则为极性分子。比如H2O分子中虽然2个H原子轴对称,但整个分子的空间构型是不对称的: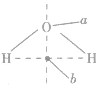 ,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
2.根据实验现象判断
将液体放入适宜的滴定管中,打开活塞让其缓慢流下,将用毛皮摩擦过的橡胶棒靠近液流,流动方向变化(发生偏移)的是极性分子.流动方向不变的是非极性分子。
3.根据中心原子最外层电子是否全部成键判断
ABn型分子中的中心原子A的最外层电子若全部成键(没有孤电子对),此分子一般为非极性分子,如CO2、CCl4等;分子中的中心原子最外层电子若未全部成键(有孤电子对),此分子一般为极性分子,如H2O、 PCl3等。
4.判断ABn型分子极性的经验规律
若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。如BF3、CO2、CH4、SO3等分子中,B、C、S等元素的化合价的绝对值等于其主族序数,是非极性分子;H2O、 NH3、SO2、PCl3等分子中,O、N、S、P等元素的化合价的绝对值不等于其主族序数,是极性分子。
分子中原子的空间关系是分子表现出不同的空间构型。
用价层电子对互斥理论确定分子或离子的VSEPR模型和立体构型的方法:
首先计算分子或离子中的中心原子的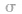 键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
1.价层电子对数的确定方法
(1) 键电子对数:由分子式确定,中心原子形成的
键电子对数:由分子式确定,中心原子形成的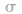 键的数目就是
键的数目就是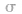 键电子对数。如
键电子对数。如 分子中的中心原子
分子中的中心原子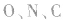 分别有2、3、4对
分别有2、3、4对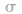 键电子对。
键电子对。
(2)孤电子对数
①分子中的中心原子上的孤电子对数
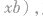 式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
以 为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则
为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则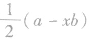 分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
②对于阳离子,a为中心原子的价电子数减去离子的电荷数;对于阴离子,a为中心原子的价电子数加上离子的电荷数(绝对值)。x和b的计算方法及计算公式[中心原子上的孤电子对数= ]均不变。
]均不变。
2.确定分子(或离子)的VSEPR模型
根据价层电子对数和价层电子对的相互排斥,可得出分子或离子的VSEPR模型,其关系如下表。 
3.确定分子(或离子)的立体构型略去VSEPR模型中的中心原子上的孤电子对,便可得到分子或离子的立体构型,如上表。
(1)分子或离子中的价层电子对数分别为2、3、4,则其VSEPR模型分别为直线形、平面三角形、正四面体形或四面体形。如果价层电子对数为5,则为三角双锥形;如果为6,则为正八面体形或八面体形。
(2)如果中心原子的孤电子对数为0,则VSEPR模型(及名称)和分子或离子的立体构型(及名称)是一致的;若孤电子对数不为0,则二者不一致。
与“(12分)A、B、C、D、E五种均为短周期元素,原子序数依次增大。...”考查相似的试题有:
- B元素与最活泼的非金属元素F形成化合物BF3,检测发现BF3分子中三根B—F键的键长相等且键角也相等,可以判断出BF3分子为______...
- 下列粒子属于等电子体的是( )A.CH4和NH4+B.NO和O2C.NH2-和H3O+D.HCl和H2O
- 下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是 ( )①H2O ②NH3 ③Cl- ④SCN-A.①②B.①②③C.①②④D.①②③④
- 下列组合中,属于含有极性键的非极性分子的是 ( )A.C2H4、C2H2、CO2B.CH4、CHCl3、CO2C.Cl2、H2、N2D.NH3、H2O、SO2
- 下列说法正确的是A.电负性最大的原子价电子构型:3S23p5B.N3-、CO2和O3互为等电子体,所以它们空间构型都是直线型C.共价键...
- 二氯化硫(Cl—S—S—Cl,直线形)是一种琥珀色液体,是合成硫化染料的重要原料。(1)写出它的电子式 。(2)指出它分子内的键型 。(3...
- [化学-选修物质结构与性质]第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.(1)Pt与Ni在周期表中位于...
- 下列分子中,没有非极性键的化合物的是( )A.H2B.CO2C.H2O2D.C2H4
- 在1molP原子形成的白磷中含有P—P键为(NA为阿氏常数)A.3NA B.1.5 NA C 4 NA D 0.25 NA
- 下列分子和离子中中心原子价层电子对几何构型为四面体且分子或离子空间构型为V形的是[ ]A.NH4+B.PH3C.H3O+D.OF2