本试题 “分析回答有关生物工程中的问题:日本下村修、美国沙尔菲和美籍华人钱永健因在研究绿色荧光蛋白(GFP)等方面的突出贡献,获得2008年度诺贝尔化学奖。下图为我国...” 主要考查您对DNA重组技术的基本工具
基因工程的基本操作程序
蛋白质工程的崛起
动物细胞的培养
动物细胞的核移植技术
胚胎工程的应用及前景
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- DNA重组技术的基本工具
- 基因工程的基本操作程序
- 蛋白质工程的崛起
- 动物细胞的培养
- 动物细胞的核移植技术
- 胚胎工程的应用及前景
DNA重组技术的基本工具:
1、基因工程的概念:
2、基本工具:
(1)“分子手术刀”——限制性核酸内切酶(限制酶)
①来源:主要是从原核生物中分离纯化出来的。
②功能:能够识别双链DNA分子的某种特定的核苷酸序列,并且使每一条链中特定部位的两个核苷酸之间的磷酸二酯键断开,因此具有专一性。
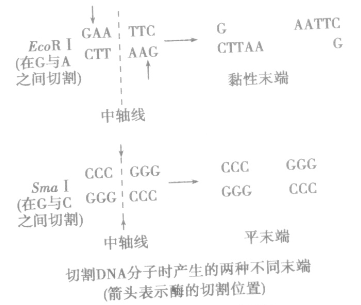
③结果:经限制酶切割产生的DNA片段末端通常有两种形式:黏性末端和平末端。
即 当限制性内切酶作用于特定的DNA时,把这段序列沿着特定的切点切开的这个过程分两种情况:
a、沿着中轴线切口(即沿着DNA双链中对应的磷酸二酯键)切开,得到的就是两个平末端;
b、在中轴线的两端切口切开,得到的就是两个黏性末端。例如:EcoRⅠ限制性内切酶就可以识别G/AATTC的DNA序列,然后在G和A间切开,得到的就是两个黏性末端(之间可以根据碱基互补配对原则重组)限制酶的切口不都是一长一短的,一长一短的叫黏性末端,一样长的叫平末端。“粘性末端”在高中教材中也作“黏性末端”。如图:
(2)“分子缝合针”——DNA连接酶
(3)“分子运输车”——载体
①载体具备的条件:能在受体细胞中复制并稳定保存;具有一至多个限制酶切点,供外源DNA片段插入;具有标记基因,供重组DNA的鉴定和选择。
②最常用的载体是质粒,它是一种裸露的、结构简单的、独立于细菌染色体之外,并具有自我复制能力的双链环状DNA分子。
③其它载体:噬菌体的衍生物、动植物病毒
1、基因工程的概念:
| 基因工程的别名 | 基因拼接技术或DNA重组技术 |
| 操作环境 | 生物体外 |
| 操作对象 | 基因 |
| 操作水平 | DNA分子水平 |
| 基本过程 | 剪切→拼接→导入→表达 |
| 结果 | 人类需要的基因产物 |
(1)“分子手术刀”——限制性核酸内切酶(限制酶)
①来源:主要是从原核生物中分离纯化出来的。
②功能:能够识别双链DNA分子的某种特定的核苷酸序列,并且使每一条链中特定部位的两个核苷酸之间的磷酸二酯键断开,因此具有专一性。
③结果:经限制酶切割产生的DNA片段末端通常有两种形式:黏性末端和平末端。
即 当限制性内切酶作用于特定的DNA时,把这段序列沿着特定的切点切开的这个过程分两种情况:
a、沿着中轴线切口(即沿着DNA双链中对应的磷酸二酯键)切开,得到的就是两个平末端;
b、在中轴线的两端切口切开,得到的就是两个黏性末端。例如:EcoRⅠ限制性内切酶就可以识别G/AATTC的DNA序列,然后在G和A间切开,得到的就是两个黏性末端(之间可以根据碱基互补配对原则重组)限制酶的切口不都是一长一短的,一长一短的叫黏性末端,一样长的叫平末端。“粘性末端”在高中教材中也作“黏性末端”。如图:

(2)“分子缝合针”——DNA连接酶
| 种类 | E·coli-DNA连接酶 | T4-DNA连接酶 |
| 来源 | 大肠杆菌 | T4噬菌体 |
| 功能特性 | 只能将双链DNA片段互补的黏性末端之间的磷酸二酯键连接起来 | 缝合两种末端,但连接平末端之间的效率较低 |
| 相同点 | 都缝合磷酸二酯键,如图: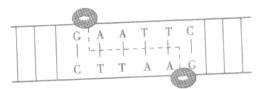 | |
(3)“分子运输车”——载体
①载体具备的条件:能在受体细胞中复制并稳定保存;具有一至多个限制酶切点,供外源DNA片段插入;具有标记基因,供重组DNA的鉴定和选择。
②最常用的载体是质粒,它是一种裸露的、结构简单的、独立于细菌染色体之外,并具有自我复制能力的双链环状DNA分子。
③其它载体:噬菌体的衍生物、动植物病毒
知识点拨:
1、限制酶识别的序列的特点:呈现碱基互补对称,无论是奇数个碱基还是偶数个碱基,都可以找到一条中心轴线,如图,中轴线两侧的双链DNA上的碱基是反向对称重复排列的。如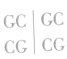 以中心线为轴,两侧碱基互补对称;
以中心线为轴,两侧碱基互补对称; 以
以 为轴,两侧碱基互补对称。
为轴,两侧碱基互补对称。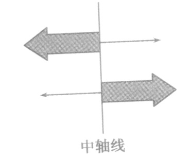
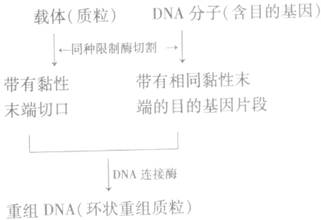
2、获取目的基因和切割载体时使用同种限制酶,目的是产生相同的黏性末端。
3、获取一个目的基因需限制酶剪切两次,共产生 4个黏性末端或平末端。
4、限制酶切割位点的选择必须保证标记基因的完整性,以便于检测。
基因工程的基本操作程序:
1、目的基因的获取
(1)目的基因是指: 编码蛋白质的结构基因。
(2)获取方法:①从基因文库中获取;②人工合成(反转录法和化学合成法);③PCR技术扩增目的基因。
2、基因表达载体的构建
(1)目的:使目的基因在受体细胞中稳定存在,并且可以遗传至下一代,使目的基因能够表达和发挥作用。
(2)组成:目的基因+启动子+终止子+标记基因。如图:
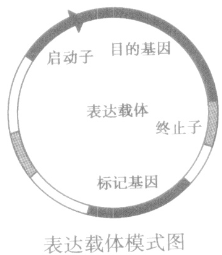
①启动子:是一段有特殊结构的DNA片段,位于基因的首端,是RNA聚合酶识别和结合的部位,能驱动基因转录出mRNA,最终获得所需的蛋白质。
②终止子:也是一段有特殊结构的DNA片段,位于基因的尾端。
③标记基因的作用:是为了鉴定受体细胞中是否含有目的基因,从而将含有目的基因的细胞筛选出来。常用的标记基因是抗生素基因。
(3)基因表达载体的构建过程:
3、将目的基因导入受体细胞
(1)转化的概念:是目的基因进入受体细胞内,并且在受体细胞内维持稳定和表达的过程。
(2)常用的转化方法:
(3)重组细胞导入受体细胞后,筛选含有基因表达载体受体细胞的依据是标记基因是否表达。
4、目的基因的检测和表达
(1)首先要检测转基因生物的染色体DNA上是否插入了目的基因,方法是采用DNA分子杂交技术。
(2)其次还要检测目的基因是否转录出mRNA,方法是用标记的目的基因作探针与mRNA杂交。
(3)最后检测目的基因是否翻译成蛋白质,方法是从转基因生物中提取蛋白质,用相应的抗体进行抗原--抗体杂交。
(4)有时还需进行个体生物学水平的鉴定。如转基因抗虫植物是否出现抗虫性状。
知识点拨:
1、构建基因文库的目的为了在不知目的基因序列的情况下,便于获得所需的目的基因。
2、PCR技术:是一项在生物体外复制特定DNA片段的核酸合成技术。PCR扩增是获取目的基冈的一种非常有用的方法,也是进行分子鉴定和检测的一种很灵敏的方法。目的:通过指数式扩增获取大量的目的基因。
3、基因文库中不是直接保管相应基因,基因文库中的基因保存在受体菌中。
4、在基因工程的四个操作步骤中,只有第三步将目的基因导入受体细胞不需碱基互补配对,其余三个步骤都涉及碱基互补配对。
5、原核生物繁殖快、多为单细胞、遗传物质相对较少,有利于目的基因的复制与表达,因此常用大肠杆菌等原核生物作为受俸细胞。
6、植物细胞的全能性较高,可经植物组织培养过程成为完整植物体,因此受体细胞可以是受精卵也可以是体细胞;动物基因工程中的受体细胞一般是受精卵。
7、转化的实质是目的基因整合到受体细胞染色体基因组中,从而使受体生物获得了新的遗传特性的现象,从其变化的实质看,这种变异属于可遗传变异中的基因重组。
知识拓展:
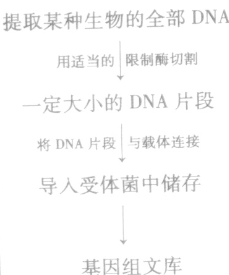
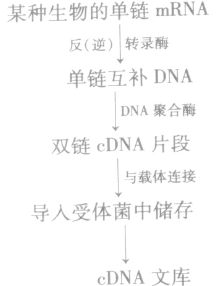
1、基因文库的构建:
(1)概念
①基因组文库:含有一种生物的全部基因。将含有某种生物不同基因的许多DNA片段,导入受体菌的群体中储存,各个受体菌分别含有这种生物的不同的基因,称为基因组文库。
②cDNA文库:只包含了一种生物的部分基因。
(2)构建过程
2、人工合成目的基因
(1)反转录法:

(2)人工合成目的基因

3、PCR技术扩增目的基因
①原理:DNA双链复制
②过程:
第一步:加热至90~95℃DNA解链;
第二步:冷却到55~60℃,引物结合到互补DNA链;
第三步:加热至70~75℃,热稳定DNA聚合酶从引物起始互补链的合成。
1、目的基因的获取
(1)目的基因是指: 编码蛋白质的结构基因。
(2)获取方法:①从基因文库中获取;②人工合成(反转录法和化学合成法);③PCR技术扩增目的基因。
2、基因表达载体的构建
(1)目的:使目的基因在受体细胞中稳定存在,并且可以遗传至下一代,使目的基因能够表达和发挥作用。
(2)组成:目的基因+启动子+终止子+标记基因。如图:

①启动子:是一段有特殊结构的DNA片段,位于基因的首端,是RNA聚合酶识别和结合的部位,能驱动基因转录出mRNA,最终获得所需的蛋白质。
②终止子:也是一段有特殊结构的DNA片段,位于基因的尾端。
③标记基因的作用:是为了鉴定受体细胞中是否含有目的基因,从而将含有目的基因的细胞筛选出来。常用的标记基因是抗生素基因。
(3)基因表达载体的构建过程:

3、将目的基因导入受体细胞
(1)转化的概念:是目的基因进入受体细胞内,并且在受体细胞内维持稳定和表达的过程。
(2)常用的转化方法:
| 生物种类 | 植物细胞 | 动物细胞 | 微生物细胞 |
| 常用方法 | 农杆菌转化法 | 显微注射技术 | Ca2+处理法 |
| 受体细胞 | 体细胞 | 受精卵 | 原核细胞 |
| 转化过程 | 将目的基因插入到Ti质粒的T-DNA上→农杆菌→导入植物细胞→整合到受体细胞的DNA→表达 | 将含有目的基因的表达载体提纯→取卵(受精卵)→显微注射→受精卵发育→获得具有新性状的动物 | Ca2+处理细胞→感受态细胞→重组表达载体与感受态细胞混合→感受态细胞吸收DNA分子 |
4、目的基因的检测和表达
(1)首先要检测转基因生物的染色体DNA上是否插入了目的基因,方法是采用DNA分子杂交技术。
(2)其次还要检测目的基因是否转录出mRNA,方法是用标记的目的基因作探针与mRNA杂交。
(3)最后检测目的基因是否翻译成蛋白质,方法是从转基因生物中提取蛋白质,用相应的抗体进行抗原--抗体杂交。
(4)有时还需进行个体生物学水平的鉴定。如转基因抗虫植物是否出现抗虫性状。
知识点拨:
1、构建基因文库的目的为了在不知目的基因序列的情况下,便于获得所需的目的基因。
2、PCR技术:是一项在生物体外复制特定DNA片段的核酸合成技术。PCR扩增是获取目的基冈的一种非常有用的方法,也是进行分子鉴定和检测的一种很灵敏的方法。目的:通过指数式扩增获取大量的目的基因。
3、基因文库中不是直接保管相应基因,基因文库中的基因保存在受体菌中。
4、在基因工程的四个操作步骤中,只有第三步将目的基因导入受体细胞不需碱基互补配对,其余三个步骤都涉及碱基互补配对。
5、原核生物繁殖快、多为单细胞、遗传物质相对较少,有利于目的基因的复制与表达,因此常用大肠杆菌等原核生物作为受俸细胞。
6、植物细胞的全能性较高,可经植物组织培养过程成为完整植物体,因此受体细胞可以是受精卵也可以是体细胞;动物基因工程中的受体细胞一般是受精卵。
7、转化的实质是目的基因整合到受体细胞染色体基因组中,从而使受体生物获得了新的遗传特性的现象,从其变化的实质看,这种变异属于可遗传变异中的基因重组。
知识拓展:
1、基因文库的构建:
(1)概念
①基因组文库:含有一种生物的全部基因。将含有某种生物不同基因的许多DNA片段,导入受体菌的群体中储存,各个受体菌分别含有这种生物的不同的基因,称为基因组文库。
②cDNA文库:只包含了一种生物的部分基因。
(2)构建过程
| 基因组文库的构建 | cDNA文库的构建 |
 |
 |
(1)反转录法:

(2)人工合成目的基因

3、PCR技术扩增目的基因
①原理:DNA双链复制
②过程:
第一步:加热至90~95℃DNA解链;
第二步:冷却到55~60℃,引物结合到互补DNA链;
第三步:加热至70~75℃,热稳定DNA聚合酶从引物起始互补链的合成。
蛋白质工程的崛起:
1、蛋白质工程的概念
蛋白质工程:指以蛋白质分子的结构规律及其生物功能的关系作为基础,通过基因修饰或基因合成,对现有蛋白质进行改造,或制造一种新的蛋白质,以满足人类的生产和生活的需求。(基因工程在原则上只能生产自然界已存在的蛋白质)。
2、蛋白质工程崛起的缘由:基因工程只能生产自然界已存在的蛋白质。
3、蛋白质工程的基本原理:它可以根据人的需求来设计蛋白质的结构,又称为第二代的基因工程。

4、基本途径:从预期的蛋白质功能出发,设计预期的蛋白质结构,推测应有的氨基酸序列,找到相对应的脱氧核苷酸序列(基因)以上是蛋白质工程特有的途径;以下按照基因工程的一般步骤进行。(注意:目的基因只能用人工合成的方法)。
5、蛋白质工程的步骤:
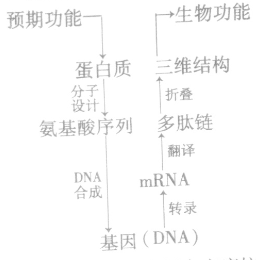
蛋白质工程和基因工程的不同:
知识拓展:
1、设计中的困难:如何推测非编码区以及内含子的脱氧核苷酸序列。
2、蛋白质工程和基因工程的区别:将目的基因导入受体细胞;基因工程合成的是天然存在的蛋白质,蛋白质工程合成的可以是天然不存在的蛋白质;蛋白质工程是在基因工程的基础上延伸出来的第二代基因工程。 蛋白质工程从分子水平对蛋白质进行改造设计,通过对相应的基因进行修饰加工甚至人工进行基因合成,从而对现有蛋白质进行改造,或制造一种新的蛋白质以满足人类生产和生活需求。而基因工程只是将外源基因导入另一生物体内,并使之表达,体现人类所需的性状,或者获取所需的产品。因此,基因工程在原则上只能生产自然界已存在的蛋白质。
1、蛋白质工程的概念
蛋白质工程:指以蛋白质分子的结构规律及其生物功能的关系作为基础,通过基因修饰或基因合成,对现有蛋白质进行改造,或制造一种新的蛋白质,以满足人类的生产和生活的需求。(基因工程在原则上只能生产自然界已存在的蛋白质)。
2、蛋白质工程崛起的缘由:基因工程只能生产自然界已存在的蛋白质。
3、蛋白质工程的基本原理:它可以根据人的需求来设计蛋白质的结构,又称为第二代的基因工程。

4、基本途径:从预期的蛋白质功能出发,设计预期的蛋白质结构,推测应有的氨基酸序列,找到相对应的脱氧核苷酸序列(基因)以上是蛋白质工程特有的途径;以下按照基因工程的一般步骤进行。(注意:目的基因只能用人工合成的方法)。
5、蛋白质工程的步骤:

蛋白质工程和基因工程的不同:
| 项目 | 蛋白质工程 | 基因工程 | |
| 区别 | 原理 | 中心发展的逆推 | 基因重组 |
| 过程 | 预期蛋白质供能→设计预期的蛋白质结构→推测应有的氨基酸序列→找到相对应的脱氧核苷酸序列→合成DNA→表达出蛋白质 | 获取目的基因→构建基因表达载体→将目的基因导入受体细胞→目的基因的检测与鉴定 | |
| 实质 | 定向改造或生产人类所需蛋白质 | 定向改造生物的遗传特性,一伙的人类所需的生物类型或生物产品(基因的异体表达) | |
| 结果 | 生产自然界没有的蛋白质 | 生产自然界已有的蛋白质 | |
| 联系 | 蛋白质工程是在基因工程基础上延伸出的第二代基因工程,因为是对现有蛋白质的改造或制造新的蛋白质,所以必须通过基因修饰或基因合成实现 | ||
知识拓展:
1、设计中的困难:如何推测非编码区以及内含子的脱氧核苷酸序列。
2、蛋白质工程和基因工程的区别:将目的基因导入受体细胞;基因工程合成的是天然存在的蛋白质,蛋白质工程合成的可以是天然不存在的蛋白质;蛋白质工程是在基因工程的基础上延伸出来的第二代基因工程。 蛋白质工程从分子水平对蛋白质进行改造设计,通过对相应的基因进行修饰加工甚至人工进行基因合成,从而对现有蛋白质进行改造,或制造一种新的蛋白质以满足人类生产和生活需求。而基因工程只是将外源基因导入另一生物体内,并使之表达,体现人类所需的性状,或者获取所需的产品。因此,基因工程在原则上只能生产自然界已存在的蛋白质。
动物细胞培养:
1、动物细胞的培养:动物细胞培养就是从动物机体中取出相关的组织,将它分散成单个细胞,然后放在适宜的培养基中,让这些细胞生长和繁殖。
2、动物细胞培养液的成分:葡萄糖、氨基酸、促生长因子、无机盐、微量元素等。
3、动物细胞培养液的特点:液体培养基含动物血清。
4、动物细胞培养需要满足以下条件
(1)充足的营养供给——微量元素、无机盐、糖类、氨基酸、促生长因子、血清等。
(2)适宜的温度:36.5℃±0.5℃;适宜的pH:7.2~7.4。
(3)无菌、无毒的环境:培养液应进行无菌处理。通常还要在培养液中添加一定量的抗生素,以防培养过程中的污染。此外,应定期更换培养液,防止代谢产物积累对细胞自身造成危害。
(4)气体环境:95%空气+5%CO2。O2是细胞代谢所必需的,CO2的主要作用是维持培养液的pH。
5、动物细胞培养的过程:
取动物组织块(动物胚胎或幼龄动物的器官或组织)→剪碎→用胰蛋白酶或胶原蛋白酶处理分散成单个细胞→制成细胞悬液→转入培养瓶中进行原代培养→贴满瓶壁的细胞重新用胰蛋白酶或胶原蛋白酶处理分散成单个细胞继续传代培养。
植物组织培养和动物细胞培养:
知识点拨:
1、细胞贴壁和接触抑制:悬液中分散的细胞很快就贴附在瓶壁上,称为细胞贴壁。细胞数目不断增多,当贴壁细胞分裂生长到表面相互抑制时,细胞就会停止分裂增殖,这种现象称为细胞的接触抑制。
2、动物细胞培养技术的应用:制备病毒疫苗、制备单克隆抗体、检测有毒物质、培养医学研究的各种细胞。
3、细胞株传至50代后,不能再传下去,但有部分存活的细胞一般能够传到40~50代,这种传代细胞叫做细胞株。
4、细胞株细胞的遗传物质没有发生改变。当细胞株传至50代以后又会出现“危机”,不能再传下去。但是有部分细胞的遗传物质发生了改变,而且带有癌变的特点,有可能在培养条件下无限制地传代下去,这种传代细胞成为细胞系。
1、动物细胞的培养:动物细胞培养就是从动物机体中取出相关的组织,将它分散成单个细胞,然后放在适宜的培养基中,让这些细胞生长和繁殖。
2、动物细胞培养液的成分:葡萄糖、氨基酸、促生长因子、无机盐、微量元素等。
3、动物细胞培养液的特点:液体培养基含动物血清。
4、动物细胞培养需要满足以下条件
(1)充足的营养供给——微量元素、无机盐、糖类、氨基酸、促生长因子、血清等。
(2)适宜的温度:36.5℃±0.5℃;适宜的pH:7.2~7.4。
(3)无菌、无毒的环境:培养液应进行无菌处理。通常还要在培养液中添加一定量的抗生素,以防培养过程中的污染。此外,应定期更换培养液,防止代谢产物积累对细胞自身造成危害。
(4)气体环境:95%空气+5%CO2。O2是细胞代谢所必需的,CO2的主要作用是维持培养液的pH。
5、动物细胞培养的过程:
取动物组织块(动物胚胎或幼龄动物的器官或组织)→剪碎→用胰蛋白酶或胶原蛋白酶处理分散成单个细胞→制成细胞悬液→转入培养瓶中进行原代培养→贴满瓶壁的细胞重新用胰蛋白酶或胶原蛋白酶处理分散成单个细胞继续传代培养。
植物组织培养和动物细胞培养:
| 项目 | 植物组织培养 | 动物细胞培养 | |
| 理论基础 | 植物细胞的全能性 | 细胞增殖 | |
| 培养基 | 类型 | (半)固体培养基 | 液体培养基 |
| 成分 | 水、矿质元素、维生素、蔗糖、氨基酸、琼脂 | 葡萄糖、氨基酸、无机盐、维生素、促生长因子、动物血清等 | |
| 取材 | 植物幼嫩部位或花药等 | 动物胚胎或出生不久的幼龄动物的器官或组织 | |
| 过程 |  |
 | |
| 结果 | 新的组织或植株个体,可以体现全能性 | 新的细胞系或细胞株,不形成个体,不体现全能性 | |
| 应用 | ①植株快速繁殖 ②脱毒植株的培育 ③人工种子 ④生产药物、杀虫剂等 ⑤转基因植物的培育 |
①蛋白质坐物制品的生产 ②皮肤移植材料的培育 ③检测有毒物质 ④生理、病理、药理学研究 | |
| 相同点 | ①两技术手段培养过程中都进行有丝分裂,都是无性繁殖,都可称克隆,都不涉及减数分裂 ②均需无菌操作,需要适宜的温度、pH等条件 | ||
知识点拨:
1、细胞贴壁和接触抑制:悬液中分散的细胞很快就贴附在瓶壁上,称为细胞贴壁。细胞数目不断增多,当贴壁细胞分裂生长到表面相互抑制时,细胞就会停止分裂增殖,这种现象称为细胞的接触抑制。
2、动物细胞培养技术的应用:制备病毒疫苗、制备单克隆抗体、检测有毒物质、培养医学研究的各种细胞。
3、细胞株传至50代后,不能再传下去,但有部分存活的细胞一般能够传到40~50代,这种传代细胞叫做细胞株。
4、细胞株细胞的遗传物质没有发生改变。当细胞株传至50代以后又会出现“危机”,不能再传下去。但是有部分细胞的遗传物质发生了改变,而且带有癌变的特点,有可能在培养条件下无限制地传代下去,这种传代细胞成为细胞系。
知识拓展:
1、动物细胞培养技术的应用
(1)生产病毒疫苗、单克隆抗体、干扰素等。
(2)利用动物细胞培养技术中的细胞贴壁生长和接触抑制的特点,可用烧伤病人自己的健康皮肤细胞培养出大量的自身薄层皮肤细胞,以供植皮所需。
(3)培养的动物细胞用于检测有毒物质,判断某种物质的毒性。
2、用胰蛋白酶处理组织块,可使细胞分散开,这样做的目的是使细胞与组织液充分接触,这也说明了细胞间的主要物质是蛋白质。
3、当动物细胞培养超过50代后,少数细胞发生突变而持续分裂成为癌变细胞。癌细胞失去了接触抑制,可以在培养瓶中形成多层细胞。
4、动物细胞培养基成分特有的动物血清含有蛋白质、氨基酸、葡萄糖、激素等多种成分.
5、植物组织培养最终产生新个体,体现全能性;动物细胞培养产生大量细胞,不形成新个体,故不能体现全能性。
动物细胞的核移植技术:
1.原理:动物细胞核的全能性和细胞膜具一定的流动性。
2.种类:动物核移植技术可以分为胚胎细胞核移植和体细胞核移植,前者比较容易。
3.材料
(1)供体细胞一般选优良动物的传代培养10代以内的细胞。
(2)受体细胞一般为减数第二次分裂中期的次级卵母细胞:①卵母细胞质内存在激发细胞核全能性表达的物质;②卵母细胞体积大,便于操作;③卵黄多,营养物质丰富。
4.过程
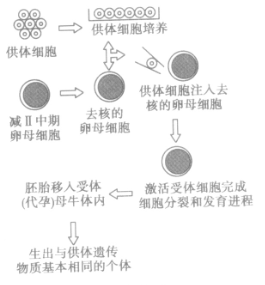
体细胞核移植的大致过程是:
高产奶牛(提供体细胞)进行细胞培养;同时采集卵母细胞,在体外培养到减二分裂中期的卵母细胞,去核(显微操作) ;将供体细胞注入去核卵母细胞;通过电刺激使两细胞融合,供体核进入受体卵母细胞,构建重组胚胎;将胚胎移入受体(代孕)母牛体内;生出与供体奶牛遗传基因相同的犊牛。
5、体细胞核移植技术的应用:
①加速家畜遗传改良进程,促进良畜群繁育;
②保护濒危物种,增大存活数量;
③生产珍贵的医用蛋白;
④作为异种移植的供体;
⑤用于组织器官的移植等。
知识点拨:
选用去核卵(母)细胞的原因:卵(母)细胞比较大,容易操作;卵(母)细胞细胞质多,营养丰富; 细胞质不会抑制细胞核全能性的表达。
知识拓展:
1、体细胞核移植技术存在的问题:克隆动物存在着健康问题、表现出遗传和生理缺陷等。
2、细胞核移植技术中注入去核卵母细胞中的不是供体细胞核,而是整个细胞,佯随着两细胞融合,体现细胞膜的结构特点:具有一定的流动性。
3、核移植时,一般先用电刺激使供受体细胞融合,再用物理或化学方法激活受体细胞,使其完成细胞分裂和发育进程。
4、克隆动物的性状与核供体生物的性状基本相同,而不是完全相同,因为克隆动物的细胞质遗传物质来自于受体卵母细胞;生物的性状不仅与遗传物质有关,还受环境的影响。
5、克隆属于无性繁殖,产生新个体的性别、绝大多数性状与供核亲本一致。
1.原理:动物细胞核的全能性和细胞膜具一定的流动性。
2.种类:动物核移植技术可以分为胚胎细胞核移植和体细胞核移植,前者比较容易。
3.材料
(1)供体细胞一般选优良动物的传代培养10代以内的细胞。
(2)受体细胞一般为减数第二次分裂中期的次级卵母细胞:①卵母细胞质内存在激发细胞核全能性表达的物质;②卵母细胞体积大,便于操作;③卵黄多,营养物质丰富。
4.过程

体细胞核移植的大致过程是:
高产奶牛(提供体细胞)进行细胞培养;同时采集卵母细胞,在体外培养到减二分裂中期的卵母细胞,去核(显微操作) ;将供体细胞注入去核卵母细胞;通过电刺激使两细胞融合,供体核进入受体卵母细胞,构建重组胚胎;将胚胎移入受体(代孕)母牛体内;生出与供体奶牛遗传基因相同的犊牛。
5、体细胞核移植技术的应用:
①加速家畜遗传改良进程,促进良畜群繁育;
②保护濒危物种,增大存活数量;
③生产珍贵的医用蛋白;
④作为异种移植的供体;
⑤用于组织器官的移植等。
知识点拨:
选用去核卵(母)细胞的原因:卵(母)细胞比较大,容易操作;卵(母)细胞细胞质多,营养丰富; 细胞质不会抑制细胞核全能性的表达。
知识拓展:
1、体细胞核移植技术存在的问题:克隆动物存在着健康问题、表现出遗传和生理缺陷等。
2、细胞核移植技术中注入去核卵母细胞中的不是供体细胞核,而是整个细胞,佯随着两细胞融合,体现细胞膜的结构特点:具有一定的流动性。
3、核移植时,一般先用电刺激使供受体细胞融合,再用物理或化学方法激活受体细胞,使其完成细胞分裂和发育进程。
4、克隆动物的性状与核供体生物的性状基本相同,而不是完全相同,因为克隆动物的细胞质遗传物质来自于受体卵母细胞;生物的性状不仅与遗传物质有关,还受环境的影响。
5、克隆属于无性繁殖,产生新个体的性别、绝大多数性状与供核亲本一致。
胚胎工程的应用及前景:
1、胚胎移植
(1)概念:是指将雌性动物的早期胚胎,或者通过体外受精及其它方式得到的胚胎,移植到同种的、生理状态相同的其它雌性动物的体内,使之继续发育为新个体的技术。其中提供胚胎的个体称为“供体”,接受胚胎的个体称为“受体”。
(2)基本程序主要包括:
①对供、受体的选择和处理。选择遗传特性和生产性能优秀的供体,有健康的体质和正常繁殖能力的受体,供体和受体是同一物种。并用激素进行同期发情处理,用促性腺激素对供体母牛做超数排卵处理。
②配种或人工授精。
③对胚胎的收集、检查、培养或保存。配种或输精后第7天,用特制的冲卵装置,把供体母牛子宫内的胚胎冲洗出来(也叫冲卵)。对胚胎进行质量检查,此时的胚胎应发育到桑椹或胚囊胚阶段。直接向受体移植或放入-196℃的液氮中保存。
④对胚胎进行移植。
⑤移植后的检查。对受体母牛进行是否妊娠的检查。
(3)胚胎移植的意义:大大缩短了供体本身的繁殖周期,充分发挥雌性优良个体的繁殖能力。
(4)胚胎移植的生理学基础:
①动物发情排卵后,同种动物的供、受体生殖器官的生理变化是相同的。这就为供体的胚胎移入受体提供了相同的生理环境。
②早期胚胎在一定时间内处于游离状态。这就为胚胎的收集提供了可能。
③受体对移入子宫的外来胚胎不发生免疫排斥反应。这为胚胎在受体的存活提供了可能。
④供体胚胎可与受体子宫建立正常的生理和组织联系,但供体胚胎的遗传特性在孕育过程中不受影响。
2、胚胎分割
(1)概念:是指采用机械方法将早期胚胎切割2等份、4等份等,经移植获得同卵双胎或多胎的技术。
(2)材料:发育良好,形态正常的桑椹胚或囊胚。(桑椹胚至囊胚的发育过程中,细胞开始分化,但其全能性仍很高,也可用于胚胎分割)
(3)理论基础:细胞的全能性。
(4)所用仪器设备:实体显微镜和显微操作仪。
(5)操作过程:选择发育良好、形态正常的桑椹胚或囊胚,移人盛有操作液的培养皿中,然后用分割针或分割刀进行分割。
(6) 意义:加快繁殖速度。
3、胚胎干细胞
(1)哺乳动物的胚胎干细胞简称ES或EK细胞,来源于早期胚胎或从原始性腺中分离出来。
(2)具有胚胎细胞的特性,在形态上表现为体积小,细胞核大,核仁明显;在功能上,具有发育的全能性,可分化为成年动物体内任何一种组织细胞。另外,在体外培养的条件下,可以增殖而不发生分化,可进行冷冻保存,也可进行遗传改造。
(3)胚胎干细胞的主要用途是:
①可用于研究哺乳动物个体发生和发育规律;
②是在体外条件下研究细胞分化的理想材料,在培养液中加入分化诱导因子,如牛黄酸等化学物质时,就可以诱导ES细胞向不同类型的组织细胞分化,这为揭示细胞分化和细胞凋亡的机理提供了有效的手段;
③可以用于治疗人类的某些顽疾,如帕金森综合症、少年糖尿病等;
④利用可以被诱导分化形成新的组织细胞的特性,移植ES细胞可使坏死或退化的部位得以修复并恢复正常功能;
⑤随着组织工程技术的发展,通过ES细胞体外诱导分化,定向培育出人造组织器官,用于器官移植,解决供体器官不足和器官移植后免疫排斥的问题。
知识点拨:
1、供体为优良品种,作为受体的雌性动物应为常见或存量大的且身体健康有良好的生育能力的品种。
2、地位:如转基因、核移植,或体外受精等任何一项胚胎工程技术所生产的胚胎,都必须经过胚胎移植技术才能获得后代,是胚胎工程的最后一道“工序”。
3、胚胎分割要求:对囊胚阶段的胚胎分割时,要将内细胞团均等分割,否则会影响分割后胚胎的恢复和进一步发育。
4、来自同一胚胎的后代具有相同的遗传物质,属于无性繁殖。
5、实质:是早期胚胎在相同生理环境条件下空间位置的转换,而胚胎本身的遗传物质并不发生改变,因此各种性状能保持其原来的优良特性。
6、优势:充分发挥雌性优良个体的繁殖潜力,从而大大缩短了供体本身的繁殖周期,大大推动了畜牧业的发展。
1、胚胎移植
(1)概念:是指将雌性动物的早期胚胎,或者通过体外受精及其它方式得到的胚胎,移植到同种的、生理状态相同的其它雌性动物的体内,使之继续发育为新个体的技术。其中提供胚胎的个体称为“供体”,接受胚胎的个体称为“受体”。
(2)基本程序主要包括:
①对供、受体的选择和处理。选择遗传特性和生产性能优秀的供体,有健康的体质和正常繁殖能力的受体,供体和受体是同一物种。并用激素进行同期发情处理,用促性腺激素对供体母牛做超数排卵处理。
②配种或人工授精。
③对胚胎的收集、检查、培养或保存。配种或输精后第7天,用特制的冲卵装置,把供体母牛子宫内的胚胎冲洗出来(也叫冲卵)。对胚胎进行质量检查,此时的胚胎应发育到桑椹或胚囊胚阶段。直接向受体移植或放入-196℃的液氮中保存。
④对胚胎进行移植。
⑤移植后的检查。对受体母牛进行是否妊娠的检查。
(3)胚胎移植的意义:大大缩短了供体本身的繁殖周期,充分发挥雌性优良个体的繁殖能力。
(4)胚胎移植的生理学基础:
①动物发情排卵后,同种动物的供、受体生殖器官的生理变化是相同的。这就为供体的胚胎移入受体提供了相同的生理环境。
②早期胚胎在一定时间内处于游离状态。这就为胚胎的收集提供了可能。
③受体对移入子宫的外来胚胎不发生免疫排斥反应。这为胚胎在受体的存活提供了可能。
④供体胚胎可与受体子宫建立正常的生理和组织联系,但供体胚胎的遗传特性在孕育过程中不受影响。
2、胚胎分割
(1)概念:是指采用机械方法将早期胚胎切割2等份、4等份等,经移植获得同卵双胎或多胎的技术。
(2)材料:发育良好,形态正常的桑椹胚或囊胚。(桑椹胚至囊胚的发育过程中,细胞开始分化,但其全能性仍很高,也可用于胚胎分割)
(3)理论基础:细胞的全能性。
(4)所用仪器设备:实体显微镜和显微操作仪。
(5)操作过程:选择发育良好、形态正常的桑椹胚或囊胚,移人盛有操作液的培养皿中,然后用分割针或分割刀进行分割。
(6) 意义:加快繁殖速度。
3、胚胎干细胞
(1)哺乳动物的胚胎干细胞简称ES或EK细胞,来源于早期胚胎或从原始性腺中分离出来。
(2)具有胚胎细胞的特性,在形态上表现为体积小,细胞核大,核仁明显;在功能上,具有发育的全能性,可分化为成年动物体内任何一种组织细胞。另外,在体外培养的条件下,可以增殖而不发生分化,可进行冷冻保存,也可进行遗传改造。
(3)胚胎干细胞的主要用途是:
①可用于研究哺乳动物个体发生和发育规律;
②是在体外条件下研究细胞分化的理想材料,在培养液中加入分化诱导因子,如牛黄酸等化学物质时,就可以诱导ES细胞向不同类型的组织细胞分化,这为揭示细胞分化和细胞凋亡的机理提供了有效的手段;
③可以用于治疗人类的某些顽疾,如帕金森综合症、少年糖尿病等;
④利用可以被诱导分化形成新的组织细胞的特性,移植ES细胞可使坏死或退化的部位得以修复并恢复正常功能;
⑤随着组织工程技术的发展,通过ES细胞体外诱导分化,定向培育出人造组织器官,用于器官移植,解决供体器官不足和器官移植后免疫排斥的问题。
知识点拨:
1、供体为优良品种,作为受体的雌性动物应为常见或存量大的且身体健康有良好的生育能力的品种。
2、地位:如转基因、核移植,或体外受精等任何一项胚胎工程技术所生产的胚胎,都必须经过胚胎移植技术才能获得后代,是胚胎工程的最后一道“工序”。
3、胚胎分割要求:对囊胚阶段的胚胎分割时,要将内细胞团均等分割,否则会影响分割后胚胎的恢复和进一步发育。
4、来自同一胚胎的后代具有相同的遗传物质,属于无性繁殖。
5、实质:是早期胚胎在相同生理环境条件下空间位置的转换,而胚胎本身的遗传物质并不发生改变,因此各种性状能保持其原来的优良特性。
6、优势:充分发挥雌性优良个体的繁殖潜力,从而大大缩短了供体本身的繁殖周期,大大推动了畜牧业的发展。
发现相似题
与“分析回答有关生物工程中的问题:日本下村修、美国沙尔菲和美...”考查相似的试题有:
- (选做题A)以重组DNA技术为核心的基因工程正在改变着人类的生活。请回答下列问题。(1)获得目的基因的方法通常包括___________...
- 下列黏性末端属于同一种限制酶切割而成的是[ ]A.①②B.②③C.①④D.①③
- 绿色荧光蛋白基因(GFP)被发现以来,一直作为一个监测完整细胞和组织内基因表达及蛋白位的理想标记。请根据图表回答下列问题。...
- 科学家将人的生长激素基因与大肠杆菌的DNA分子进行重组,并成功地在大肠杆菌中得以表达。过程如下图,据图回答:(1)过程①表示...
- 科学家为提高玉米中赖氨酸含量,计划将天冬氨酸激酶的第352位的苏氨酸变成异亮氨酸,将二氢吡啶二羧酸合成酶中104位的氨基酸...
- 人的血清白蛋白(HAS)在临床上需求量很大,通常从血液中提取但由于艾滋病病毒等的威胁与日俱增,使人们对血液制品顾虑重重。如...
- 关于现代生物技术相关知识的叙述,正确的是[ ]A.动物细胞培养与动物组织培养均需使用胰蛋白酶制备体细胞悬液B.植物组织培养...
- 胚胎分割要将内细胞团均等分割的原因是[ ]A.以免影响胚胎的恢复和进一步发育B.保证遗传物质的平均分配C.确保胚胎发育后期...
- (选做题)请回答有关图示问题:(1)图甲中①一③所示的生物工程为_______。该工程是指以蛋白质分子的结构规律及其与生物功能的关...
- 阅读下列材料,回答问题。克隆牛“蓓蓓”是我国成功繁殖的首例和第二例胎儿皮肤上皮细胞克隆牛“康康”和“双双”的后代。我国研究...