本试题 “已知乙醇可以和氯化钙反应,生成微溶于水的CaCl2•6C2H5OH.有关试剂的部分数据如下:物 质熔点(℃)沸点(℃)密度(g/cm3)乙 醇-117.078.00.79乙 酸16.61...” 主要考查您对乙酸乙酯的制备
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 乙酸乙酯的制备
乙酸乙酯的制备:
(1)实验目的:
掌握用醇和羧酸制备酯的方法。
(2)试剂:
乙醇、冰醋酸、浓硫酸、饱和碳酸钠水溶液、饱和食盐水、饱和氯化钙、无水硫酸镁(或无水硫酸钠) 2~3g (用于干燥乙酸乙酯)
(3)反应原理:
主反应: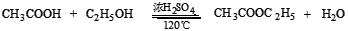
副反应: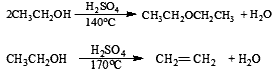
(4)反应装置图:
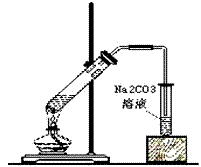
(5)操作步骤
①在一个大试管里注入乙醇2mL,再慢慢加入0.5mL浓硫酸、2mL乙酸,连接好制备乙酸乙酯的装置。
②用小火加热试管里的混合物。把产生的蒸气经导管通到3mL饱和碳酸钠溶液的上方约2mm~3mm处,注意观察盛碳酸钠溶液的试管的变化,待有透明的油状液体浮在液面上,取下盛有碳酸钠溶液的试管,并停止加热。振荡盛有碳酸钠溶液的试管,静置,待溶液分层后,观察上层液体,并闻它的气味。
③加热混合物一段时间后,可看到有气体放出,在盛碳酸钠溶液的试管里有油状物。
(6)注意事项:
1、酯化反应所用仪器必须无水,包括量取乙醇和冰醋酸的量筒也要干燥。
2、加热之前一定将反应混合物混合均匀,否则容易炭化。
3、分液漏斗的正确使用和维护。。
4、用10%碳酸钠水溶液洗涤有机相时有二氧化碳产生,注意及时给分液漏斗放气,以免气体冲开分液漏斗的塞子而损失产品。
5、正确进行蒸馏操作,温度计的位置影响流出温度,温度计水银球的上沿与蒸馏头下沿一平。
6、有机相干燥要彻底,不要把干燥剂转移到蒸馏烧瓶中。
7、反应和蒸馏时不要忘记加沸石。
8、用CaCl2溶液洗之前,一定要先用饱和NaCl溶液洗,否则会产生沉淀,给分液带来困难。
(1)实验目的:
掌握用醇和羧酸制备酯的方法。
(2)试剂:
乙醇、冰醋酸、浓硫酸、饱和碳酸钠水溶液、饱和食盐水、饱和氯化钙、无水硫酸镁(或无水硫酸钠) 2~3g (用于干燥乙酸乙酯)
(3)反应原理:
主反应:
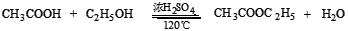
副反应:
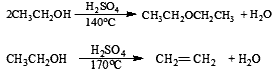
(4)反应装置图:

(5)操作步骤
①在一个大试管里注入乙醇2mL,再慢慢加入0.5mL浓硫酸、2mL乙酸,连接好制备乙酸乙酯的装置。
②用小火加热试管里的混合物。把产生的蒸气经导管通到3mL饱和碳酸钠溶液的上方约2mm~3mm处,注意观察盛碳酸钠溶液的试管的变化,待有透明的油状液体浮在液面上,取下盛有碳酸钠溶液的试管,并停止加热。振荡盛有碳酸钠溶液的试管,静置,待溶液分层后,观察上层液体,并闻它的气味。
③加热混合物一段时间后,可看到有气体放出,在盛碳酸钠溶液的试管里有油状物。
(6)注意事项:
1、酯化反应所用仪器必须无水,包括量取乙醇和冰醋酸的量筒也要干燥。
2、加热之前一定将反应混合物混合均匀,否则容易炭化。
3、分液漏斗的正确使用和维护。。
4、用10%碳酸钠水溶液洗涤有机相时有二氧化碳产生,注意及时给分液漏斗放气,以免气体冲开分液漏斗的塞子而损失产品。
5、正确进行蒸馏操作,温度计的位置影响流出温度,温度计水银球的上沿与蒸馏头下沿一平。
6、有机相干燥要彻底,不要把干燥剂转移到蒸馏烧瓶中。
7、反应和蒸馏时不要忘记加沸石。
8、用CaCl2溶液洗之前,一定要先用饱和NaCl溶液洗,否则会产生沉淀,给分液带来困难。
发现相似题
与“已知乙醇可以和氯化钙反应,生成微溶于水的CaCl2•6C2H5OH.有...”考查相似的试题有:
- 下面是甲、乙、 丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验。[实验目的]制取乙酸乙酯[实验原理](1)甲、...
- 下列实验方案合理的是[ ]A.配制50g质量分数为5%的NaCl溶液:将45mL水加入到盛有5g NaCl的烧杯中,搅拌溶解B.制备乙酸乙酯用...
- 下列说法正确的是( ) A.图1为实验室制备硝基苯的装置 B.图2中振荡后下层为无色 C.用图3所示的实验装置制备乙酸乙酯 D....
- 下列实验操作或步骤正确的是( )A.在制备乙酸乙酯的过程中,在大试管中加入药品的顺序是乙醇,浓硫酸,乙酸B.做CH4与氯气...
- 下列实验装置不合理的是( )A.溴苯的制备B.硝基苯制备C.用乙醇和浓硫酸制乙烯D.乙酸乙酯的制备
- 实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气...
- 下列实验操作或步骤正确的是( )A.在制备乙酸乙酯的实验中,在大试管中加入药品的顺序是乙醇、浓硫酸、乙酸,反应时将产生...
- 下列实验叙述不正确的是( )A.从试剂瓶中取出并切下使用的钠块后,剩余的钠不能放回原试剂瓶B.过滤时,将烧杯尖嘴靠在玻璃...
- 下列说法正确的是( )A.淀粉、纤维素、油脂、蛋白质都是天然有机高分子化合物B.实验室只用乙醇和乙酸混合加热就可以制取乙...
- 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图。下列对该实验的描述错误的是[ ...