本试题 “下列说法正确的是( )A.某盐的水溶液呈酸性,该盐一定是强酸弱碱盐B.强电解质溶液稀释后,溶液中各种离子浓度一定都减少C.水的离子积常数Kw随着温度的升...” 主要考查您对水电离的影响因素
水的电离平衡
盐类水解的定义
溶液pH的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水电离的影响因素
- 水的电离平衡
- 盐类水解的定义
- 溶液pH的有关计算
影响水电离平衡的因素:
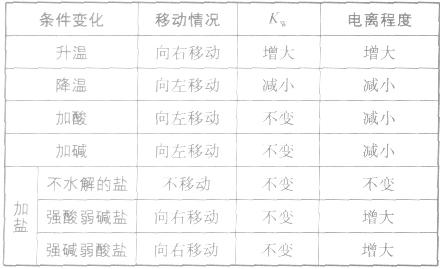
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
盐类水解:
1.定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
2.实质:生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
3.条件:盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
4.特点:可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
5.规律:有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时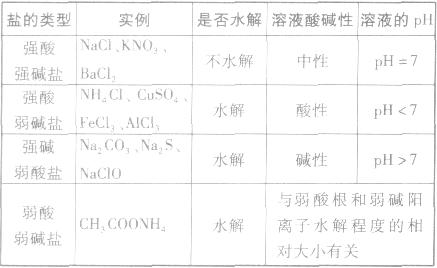
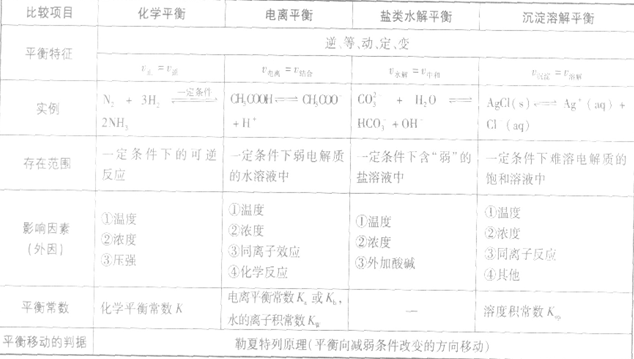
四种重要的动态平衡的比较:
溶液pH的计算方法:
总体原则
(1)若溶液为酸性,先求C(H+),再求pH;
(2)若溶液为碱性,先求C(OH-),再由 ,最后求pH。
,最后求pH。
1.单一溶液pH的计算
(1)强酸溶液,如 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为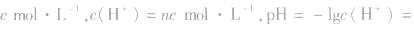
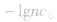
(2)强碱溶液,如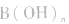 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为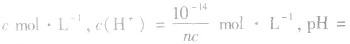
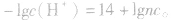
2.两强酸混合后pH的计算
由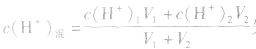 先求出混△后的
先求出混△后的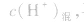 再根据公式
再根据公式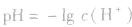 求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
3.两强碱混合后pH的计算
由 先求出混台后的
先求出混台后的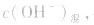 再通过
再通过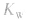 求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
4.强酸与强碱混合后pH的计算
强酸与强碱混合的实质是中和反应即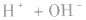
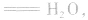 中和后溶液的pH有以下几种情况:
中和后溶液的pH有以下几种情况:
(1)若恰好中和,pH=7。
(2)若剩余酸,先求中和后的c(H+),再求pH。
(3)若剩余碱,先求中和后的c(OH-),再通过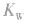 求出
求出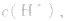 最后求pH.
最后求pH.
注意:强酸与强碱等体积混合后溶液酸碱性的判断规律:
①若二者pH之和为14,则混合后的溶液呈中性, pH=7
②若二者pH之和大于14,则混合后的溶液呈碱性
③若二者pH之和小于14,则混合后的溶液呈酸性,
5.溶液稀释后求pH
(1)对于强酸溶液,每稀释10倍体积,pH增大1 个单位;对于弱酸溶液,每稀释10倍体积,pH增大不足一个单位。无论稀释多少倍,酸溶液的pH不能等于或大于7,只能趋近于7。
(2)对于强碱溶液,每稀释10倍体积,pH减小1 个单位;对于弱碱溶液,每稀释10倍体积,pH减小不足一个单位。无论稀释多少倍,碱溶液的pH不能等于或小于7,只能趋近于7。
例如:pH=6的HCl溶液稀释100倍,溶液pH≈7 (不能大于7);
pH=8的NaOH溶液稀释100倍,溶液pH≈7(不能小于7):
pH=3的HCl溶液稀释100倍,溶液pH=5;
pH=10的NaOH溶液稀释100倍,溶液pH=8。
注意:弱酸、弱碱的稀释:在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范同。
例如:pH=3的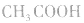 溶液稀释100倍,稀释后
溶液稀释100倍,稀释后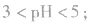
pH=10的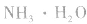 溶液稀释100倍,稀释后8<
溶液稀释100倍,稀释后8<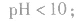
pH=3的酸溶液稀释100倍,稀释后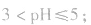
pH=10的碱溶液稀释100倍,稀释后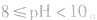
与“下列说法正确的是( )A.某盐的水溶液呈酸性,该盐一定是强...”考查相似的试题有:
- 下列物质加入水中,能使水的电离程度增大,且所得溶液显酸性的是( )A.CH3COOHB.Al2(SO4)3C.NaHSO4D.Na2CO3
- 某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积KW= 。在此温度下,将 pH = a的 NaOH 溶液 VaL 与...
- (12分)在温度T ℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的...
- 室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是A.若PH>7,则...
- 如图,abcd分别代表酸碱溶液加水稀释后pH与加水的体积的关系。下列判断正确的是( )A.a和b为强电解质B.等体积的c和d分别与...
- 有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是[ ]A.在三种酸HX、HY、HZ中以HX酸性...
- 部分弱酸的电离平衡常数如下表:弱酸HCOOHHCNH2CO3电离平衡常数(25℃)Ki=1.77×10-4Ki=4.9×10-10Ki1=4.3×10-7Ki2=5.6×...
- 在0.1 mol/L的Na2CO3溶液中,下列关系正确的是( )A.c(Na+)=2c(CO)B.c(OH-)=2c(H+)C.c(HCO)>c(H2CO3)D.c(Na+)
- 等体积混和0.10摩/升盐酸和0.06摩/升Ba(OH)2溶液后,溶液的pH值等于( )A.2.0B.12.3C.1.7D.12.0
- 在25℃时,将pH=12的NaOH溶液与pH=2的CH3COOH溶液等体积混合,下列有关所得溶液的说法中错误的是( ) A.溶液一定呈酸性 B....