本试题 “黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:现称取研细的黄铜矿...” 主要考查您对测定物质组成、成分含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测定物质组成、成分含量
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
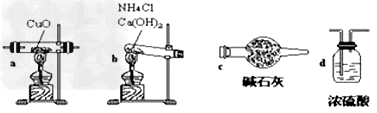
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
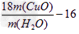
发现相似题
与“黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种...”考查相似的试题有:
- 通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的...
- 化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成.图中所列...
- 亚硫酸盐是一种常见食品添加剂。为检测某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组设计了如下两种实验...
- 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出)(1)将...
- 某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是( )A.分子中的C、H、O的个数比为1...
- 电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置(1)产生的...
- 硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气(内含N2、O2、CO2、SO2等)中二氧化硫的体积分数设计...
- 实验室有一包暗红色粉末样品可能是CaCO3、Fe2O3或FeO的混合物。后经测定已确定不存在FeO。Ⅰ.某学生想自己设计实验方案,以证...
- 硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下请同答下列问题:(1)步骤...
- 某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量(硅是一种很不活泼的非金属单质,不能与除HF外的所有酸发生反...