本试题 “下列叙述正确的是 [ ]A.海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t。由于海水中镁的储量很大,工业上常...” 主要考查您对影响化学平衡的因素
氨基酸
食品添加剂的使用
海水资源的综合利用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 影响化学平衡的因素
- 氨基酸
- 食品添加剂的使用
- 海水资源的综合利用
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
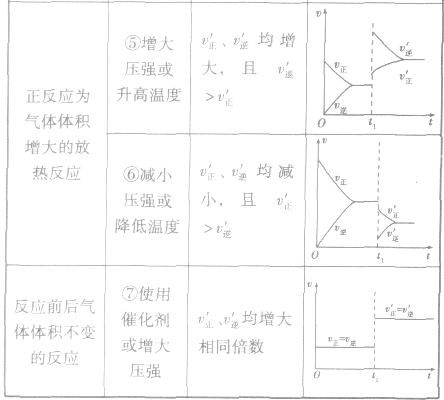
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应
 来说,加压,
来说,加压,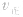 增大、
增大、 增大,
增大,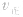 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,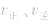 均减小,
均减小,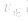 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图: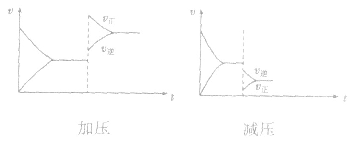
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
对于
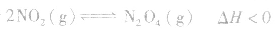 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图: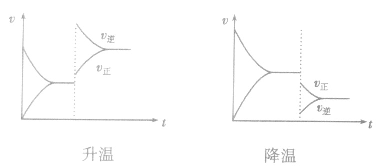
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为
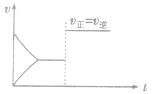
稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体
 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。 2.恒温恒压时
充入稀有气体
 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了
 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。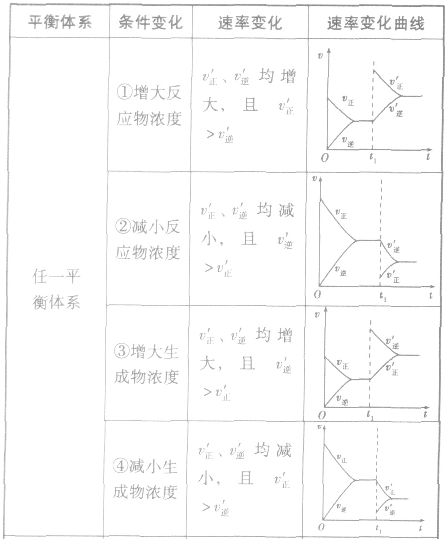
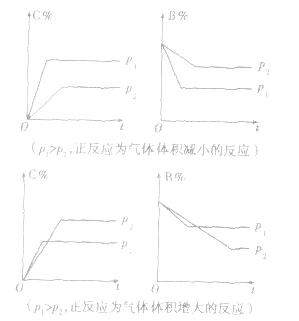
2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。

3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:
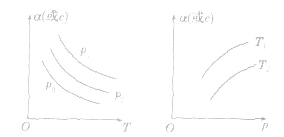
小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g)
 bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
(2)若反应物不止一种时,如aA(g)+bB(g)
 cC(g)+dD(g):
cC(g)+dD(g): a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如
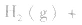
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。 4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,
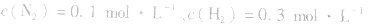 ,
,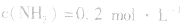 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让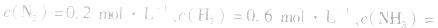
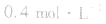 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。 5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如
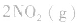
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物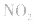 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小氨基酸的结构:
氨基酸是羧酸分子烃基上的氢原子被氨基取代的化合物。组成蛋白质的氢基酸几乎都是α一氨基酸,其结构简式为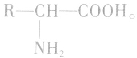
如甘氨酸(氨基乙酸):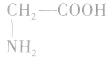
丙氨酸(α一氨基丙酸):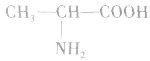
谷氨酸(2一氨基一1,5一戊二酸):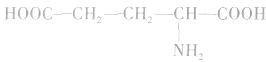
氨基酸的性质:
(1)物理性质天然的氨基酸均为无色晶体,熔点较高,在200~ 300℃熔化时分解。它们能溶于强酸或强碱溶液,除少数外一般都能溶于水,而难溶于乙醇、乙醚。
(2)化学性质
a.氨基酸的两性
氨基酸分子中一COOH是酸性基团,一NH2是碱性基因。因此,氨基酸是两性化合物,它既可以与酸反应,也可以与碱反应,且都生成盐。 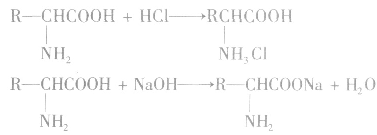
b.成肽反应
两个氨基酸分子(可以相同,也可以不同),在酸或碱的存在下加热,通过一分子的氨基与另一分子的羧基问脱去一分子水,缩合形成含有肽踺的化合物,称为成肽反应。由两个氨基酸分子脱水后形成的含有肽键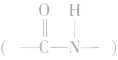 的化合物称为二肽。二肽还可以继续与其他氨基酸分子脱水生成三肽、四肽、五肽以至生成长链的多肽。
的化合物称为二肽。二肽还可以继续与其他氨基酸分子脱水生成三肽、四肽、五肽以至生成长链的多肽。
(1)着色剂:分天然和人造 胡萝卜素、胭脂红、柠檬黄、苋菜红、(苏丹红)婴儿食品不加色素
(2)调味剂:食盐咸,过多会高血压,味精过多过敏口渴等,醋有酸味
(3)防腐剂:食盐、糖、醋、苯甲酸钠、硝酸盐、二氧化硫、亚硝酸钠(可变成亚硝胺)
(4)营养强化剂:食盐中加碘(KIO3)、酱油中加铁、粮食中加赖氨酸、食品加维生素、钙、硒、锗
浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
海水制盐:
(1)海水制盐的方法:从海水中得到食盐的方法有蒸发法(盐田法)、电渗析法等。目前,以蒸发法(盐田法)为主。
(2)海水晒盐的基本原理:水分不断蒸发,氯化钠等盐结晶析出。
(3)海水晒盐的流程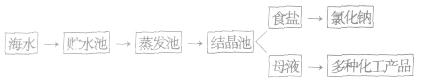
氯碱工业:
(1)食盐水的精制
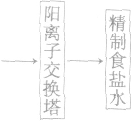
(2)电极反应
阴极: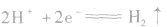
阳极:
总反应: :
:
(3)主要设备
离子交换膜电解槽一一阳极用金属钛(表面涂有钛、钉氧化物层)制成,阴极用碳钢(覆有镍镀层)制成。阳离子膜具有选择透过性,只允许Na+透过,而Cl-、 OH一和气体不能透过。 
(4)产品及用途
烧碱:可用于造纸、玻璃、肥皂等工业
氯气:可用于制农药、有机合成、氯化物的合成
氢气:可用于金属冶炼、有机合成、盐酸的制取
海水提溴:
(1)氯化
氯化氧化溴离子,在pH=3.5的酸性条件下效果最好,所以在氯化之前要将海水酸化。
(2)吹出
当海水中的Br一被氧化成Br2以后,用空气将其吹出。另外,也可以用水蒸气,使溴和水蒸气一起蒸出。
(3)吸收
目前比较多的是用二氧化硫作还原剂,使溴单质转化为HBr,再用氯气将其氧化得到溴产品。化学方程式如下: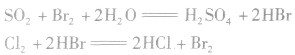
海水提镁:
(1)工艺流程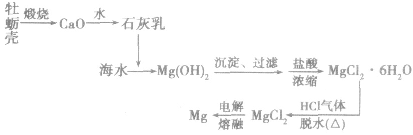
(2)主要化学反应
①制备石灰乳: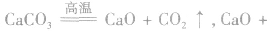
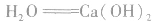
②沉淀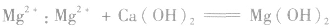
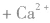
③制备
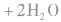
从海水中提取重水:
提取重水的方法:蒸馏法、电解法、化学交换法、吸附法等。常用方法:化学交换法(硫化氢一水双温交换法)
铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水对一个国家来说具有战略意义,化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能也是越来越受到重视的新型能源。
与“下列叙述正确的是 [ ]A.海水中蕴含的元素有80多种,其中Mg、...”考查相似的试题有:
- 在密闭容器中进行反应:X2(g)+3Y2(g)2Z(g)其中X2、Y2、Z的起始溶度分别为0.10 mol/L、0.30 mol/L、0.20 mol/L,在一定条件...
- mA(g) + nB(g) pC(g)在同一压强下变化如图,下列叙述正确的是A.T1>T2正反应是吸热反应B.T1<T2正反应是放热反应C.T1<T2...
- 温度为T0时,在恒容的密闭容器中发生反应,各物质的浓度随时间变化的关系如图(a)所示。其他条件相同,温度分别为T1、T2时发生...
- X、Y、Z三种气体,取X和Y按2∶1的物质的量之比混合,放入固定体积的密闭容器中发生如下反应:X + 2Y 2Z,达到平衡后,X的转化...
- 一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是A...
- 化学与科学、技术、社会和环境密切相关。下列说法正确的是( )A.化学平衡常数是指一定条件下的可逆反应,生成物浓度的幂之积...
- 下列说法中,不正确的是 ( )A.石油的分馏主要是物理变化而煤的干馏主要是化学变化B.乙醇、乙酸乙酯、乙酸能用饱和碳酸钠...
- 2006年诺贝尔化学奖授予美国科学家Roger.D.Kormberg,他揭示了真核生物体内细胞如何利用基因内存储的信息合成蛋白质。下列关...
- 下列情况会对人体健康造成较大危害的是( )A.用小苏打(NaHCO3)发酵面团制作馒头B.用食醋清洗热水瓶胆内壁附着的水垢C....
- 我省东临大海,利用海水等可制得多种化工产品.下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,...