本试题 “碳和碳的化合物都是非常重要的物质。(1)碳原子的结构示意为,碳原子的核电荷数为________。(2)碳的单质有多种,具有下列结构的碳单质中,由分子构成的是_...” 主要考查您对原子结构示意图
金刚石、石墨、C60的结构和用途
二氧化碳的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子结构示意图
- 金刚石、石墨、C60的结构和用途
- 二氧化碳的性质
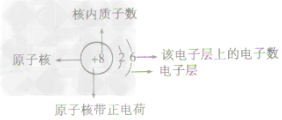
原子结构示意图(如图)是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
原子结构示意图及各部分的含义:
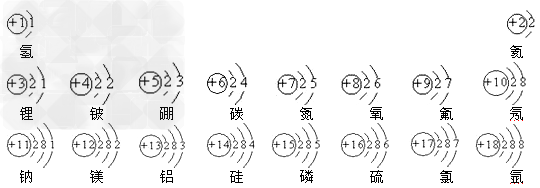
前20号元素的原子结构示意图:
金刚石俗称“金刚钻”。也就是我们常说的钻石,它是一种由纯碳组成的矿物。金刚石是自然界中最坚硬的物质。金刚石的用途非常广泛,例如:工艺品、工业中的切割工具。碳可以在高温、高压下形成金刚石。

石墨:
石墨是元素碳的一种同素异形体,每个碳原子的周边连结著另外三个碳原子(排列方式呈蜂巢式的多个六边形)以共价键结合,构成共价分子。由于每个碳原子均会放出一个电子,那些电子能够自由移动,因此石墨属于导电体。石墨是其中一种最软的矿物,它的用途包括制造铅笔芯和润滑剂。

C60:
C60分子是一种由60个碳原子构成的分子,它形似足球,因此又名足球烯。(C60这种物质是由C60分子组成的,而不是由原子构成的。) C60是单纯由碳原子结合形成的稳定分子,它具有60个顶点和32个面,其中12个为正五边形,20个为正六边形。其相对分子质量约为720。
金刚石,石墨,碳60性质及用途比较
| 名称 | 金刚石 | 石墨 | 碳60 |
| 外观 | 纯净无色透明,正八 面体形状的晶体 |
深灰色,有金属光泽,不 透明的细鳞片状的固体, 质软,有滑腻感 |
分子型似足球状, 有金属光泽,其微晶 粉末呈黄色 |
| 结构模型 |  |
 |
 |
| 导电性 | 几乎不导电 | 良好 | 几乎不导电 |
| 硬度 | 天然存在的最硬物质 | 质软 | 质脆 |
| 导热性 | 很差 | 良好 | 很差 |
| 熔点 | 很高 | 很高 | 较低 |
| 用途 | 钻头,刻刀,装饰品 | 电极,铅笔芯,润滑剂 | 制备新材料,新配 件,医学应用 |
| 区别与联系 | 金刚石、石墨,C60,,的物理性质有很大差异,原因是这些单质中碳原子的排列方式不同,但由于它们都是由碳元素组成的单质,故化学性质相同。金刚石与石墨通过化学反应可以相互转变。 | ||
人造金刚石:
20世纪80年代,人们发现人造金刚石在半导体制造行业具有广泛的应用前景。因为计算机芯片的基体材料—硅的导热性不好,这成为进一步提高芯片性能的难题。而金刚石在导热性方而远远超过硅(甚至超过铜和银),于是它成了芯片基体材料的最佳选择。正是这种需求推动了人造金刚石的研究。
碳纤维:
碳纤维是一种纤维状碳材料,它是将有机纤维与塑料树脂结合在一起,放在惰性气氛中,在一定压强下加强热、炭化而成的。碳纤维是一种强度比钢大,密度比铝小,比不锈钢还耐腐蚀,比耐热钢还耐高温,又能如铜那样导电,具有电学、热学和力学性能的新型材料。用碳纤维与塑料制成的复合材料,可以代替铝合金来制造飞机。制成的飞机,不仅轻巧,而且消耗动力少、推力大、噪音小。用碳纤维制电子计算机的磁盘,能提高计算机的贮存量和运算速率。用碳纤维增强塑料来制造卫星和火箭等宇宙飞行器,机械强度高,质量小,可节省大量的燃料。总之,用碳纤维或碳纤维增强的塑料、玻璃、陶瓷和金属等材料来代替钢材和合金等,在化工、机电、造船,特别是飞机制造、宇航器材等领域中有广泛的应用。
二氧化碳是空气中常见的化合物,其分子式为CO?,由两个氧原子与一个碳原子通过共价键连接而成,常温下是一种无色无味气体,密度比空气略大,能溶于水,与水反应生成碳酸。固态二氧化碳俗称干冰。二氧化碳被认为是造成温室效应的主要来源。
物理性质:
常温下,二氧化碳是一种无色无味的气体,密度比空气大,能溶于水。
固态的二氧化碳叫做干冰。
化学性质:
(1)一般情况下,二氧化碳不能燃烧,也不支持燃烧,不供给呼吸,因此当我们进入
干枯的深井,深洞或久未开启的菜窖时,应先做一个灯火实验,以防止二氧化碳浓度
过高而造成危险
(2)二氧化碳和水反应生成碳酸,使紫色石蕊试液变红:CO2 + H2O===H2CO3,
碳酸不稳定,很容易分解成水和二氧化碳,所以红色石蕊试液又变回紫色:
H2CO3===H2O + CO2↑
(3)二氧化碳和石灰水反应:Ca(OH)2 + CO2====CaCO3↓+ H2O
(4)二氧化碳可促进植物的光合作用:6CO2+6H2O
 C6H12O6+6O2
C6H12O6+6O2 一氧化碳和二氧化碳性质的比较:
|
|
|
一氧化碳 |
二氧化碳 |
|
物理性质 |
状态 |
无色,无味气体 |
无色,无味气体 |
|
密度 |
1.250g/l(略小于空气) |
1.977g/l(大于空气) | |
|
溶解性 |
1体积水中约溶解0.02体积 |
1体积中约溶解1体积 | |
|
化学性质 |
可燃性 |
有可燃性 |
一般情况下,既不能燃烧,也不能支持燃烧 |
|
还原性 |
有还原性: |
没有还原性 | |
|
跟水反应 |
不能 |
能:CO2+H2O==H2CO3 | |
|
跟澄清石灰水反应 |
不能 |
CO2+Ca(OH)2==CaCO3↓+H2O | |
|
毒性 |
有毒 |
无毒 | |
|
主要用途 |
作气体燃料,用于高炉炼铁 |
灭火,人工降雨,干冰制冷剂等,作化工原料和温室肥料 | |
|
相互转化 |
C+O2 CO2 CO2C+CO2  2CO 2CO | ||
干冰:
一定条件下,二氧化碳气体会变成固体,固体二氧化碳叫“干冰”。干冰升华时,吸收大量的热,因此可作制冷剂。如果用飞机向云层中撤干冰,由于干冰升华吸热,空气中的水蒸气迅速冷凝变成水滴,就可以形成降雨。
二氧化碳不一定能灭火:
二氧化碳一般不支持燃烧,但在一定条件下,某些物质也可以在二氧化碳中燃烧,如将点燃的镁条伸入盛有二氧化碳的集气瓶中,镁条能继续燃烧,反应的化学方程式为:2Mg+CO2
 2MgO+C,所以活泼金属着火不能用二氧化碳来灭火
2MgO+C,所以活泼金属着火不能用二氧化碳来灭火 二氧化碳与一氧化碳的鉴别方法:
(1)澄清石灰水:将气体分别通入澄清石灰水中,能使澄清石灰水变浑浊的是二氧化碳,无明显现象的是一氧化碳。
(2)燃着的木条:将气体分别在空气中点燃,能燃烧的是一氧化碳,不能燃烧的是二氧化碳。
(3)紫色石蕊试液:将气体分别通入紫色石蕊试液中,能使石蕊试液变红的是二氧化碳,无明显现象的是一氧化碳。
(4)还原金属氧化物:将气体分别通过灼热的氧化铜,出现黑色粉末变红这一现象的是一氧化碳,没有明显现象的是二氧化碳。
二氧化碳与一氧化碳的除杂方法:
1.CO(CO2)(括号内的物质为杂质):通常将气体通人过量的碱溶液(一般用氢氧化钠溶液而不用澄清石灰水)中,二氧化碳与碱溶液反应,从而达到除杂的目的。
2.CO2(CO)(括号内的物质为杂质):通常将气体通过灼热的氧化铜,一氧化碳与氧化铜反应生成铜和二氧化碳,从而达到除杂的目的。不能用点燃的方法,因为CO2不支持燃烧,也不能燃烧。
二氧化碳与石灰石的应用:
二氧化碳与石灰水反应出现白色沉淀,反应的方程式为:CO2+Ca(OH)2==CaCO3↓+H2O。
该反应及现象有以下儿方面的应用:
(1)检验二氧化碳气体;
(2)鉴别NaOH溶液和澄清石灰水:将CO2气体通入待测溶液中,生成白色沉淀的溶液为澄清石灰水,无明显现象的为NaOH溶液;
(3)除去某些气体中的杂质:如除去CO中的CO2 气体,可将混合气体通过澄清石灰水;
(4)解释澄清石灰水为什么要密封保存:敞口放置的澄清石灰水会吸收空气中的CO2而使澄清石灰水表面生成一层白膜或变浑浊,其成分是CaCO3;
(5)用石灰砂浆砌砖抹墙不久后变白变硬:石灰砂浆的主要成分是Ca(OH)2,吸收空气中的CO2发生反应Ca(OH)2声称白色固体CaCO3固体。
(6)保存鸡蛋:将鸡蛋浸泡在澄清石灰水中,取出来后CO2与石灰水反应封闭鸡蛋壳上的小孔,可以延长鸡蛋的保存时间。
二氧化碳肥料:
二氧化碳是光合作用的原料之一,因而现在在温室大棚内种植蔬菜水果时,经常人为提高温室内CO2 浓度,以增加农作物产员,增大CO2浓度的方法通常有以下几种:
(1)在温室内放置干冰,干冰升华增大CO2浓度。
(2)在温室内放置通过化学反应产生CO2气体的物质,如在塑料大棚顶部的容器内放置石灰石和稀盐酸。
灯火实验:
(1)二氧化碳本身无毒,但它不供给呼吸,当空气中二氧化碳含量超过常量时,也会对人体健康产生不良影响。
| 空气中二氧化碳的体积分数/% | 对人体健康的影响 |
| 1 | 感到气闷,头昏,心悸 |
| 4—5 | 气喘,头痛,眩晕 |
| 10 | 神志不清,呼吸停止,死亡 |
与“碳和碳的化合物都是非常重要的物质。(1)碳原子的结构示意为...”考查相似的试题有:
- 已知钠原子的原子核内有11个质子,下列能正确表示钠离子结构示意图的是( )A.B.C.D.
- 图是某粒子的结构示意图.下列说法正确的是 ( )A.该粒子的质子数是12B.该粒子是离子C.该元素是非金属元素D.该粒子容易...
- 在日常生活中①石墨、②碘酸钾(KIO3)、③CaCO3、④C2H5OH等物质都有重要的用途,选择上述物质的编号填入相应空格内:(1)为防...
- 金刚石和石墨都是[ ]A.有金属光泽的无色透明晶体B.电的良导体C.非常坚硬的物质D.由碳元素形成的单质
- 体会内在联系,填写下表内容:物质名称(1) 石墨组成元素CC微观结构模型 物质性质颜色无色黑色颜色(2) 小颜色不导电导电用...
- 可用同一化学原理解释的下列现象是( )①久置的石灰水液面上出现一层白色薄膜;②向澄清石灰水中不断吹气,石灰水变浑浊;③为...
- 将一个干冷的烧杯罩在蜡烛火焰的上方,烧杯内壁上出现细小的水珠;将烧杯迅速倒转过来,倒入少量澄清石灰水,振荡,石灰水变...
- 下列有关碳及其氧化物的说法错误的是( )A.C0与C02可用澄清石灰水区分B.C0具有还原性,可用于铁的冶炼C.C02的过多排放可...
- 下列关于一氧化碳和二氧化碳的说法正确的是( )A.都能与水反应B.都能与KOH溶液反应C.都能还原氧化铜D.都能通过碳与氧气...
- 请回忆老师做的“二氧化碳与水反应”的实验并分析下列四组对比实验回答问题:(Ⅰ)组:向装有2mL稀醋酸的试管中滴加两滴紫色石...
 2CO2
2CO2 Cu+CO2
Cu+CO2