本试题 “在18℃时,H2SO3的K1=1.5×10-2、K2=1.0×10-7,H2S的K1=9.1×10-8、K2=1.1×10-12,则下列说法中正确的是[ ]A.亚硫酸的酸性弱于氢硫酸B.多元弱酸的酸性主要由第...” 主要考查您对电离平衡常数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电离平衡常数
电离平衡常数:
1.概念在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K表示(酸用 表示,碱用
表示,碱用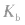 表示)。
表示)。
2.表示方法: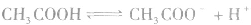
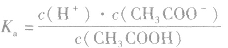
对于多元弱酸,其电离是分步进行的,每步各有电离常数,通常用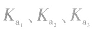 ,等分别表示,且
,等分别表示,且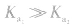
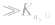
例如: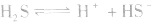
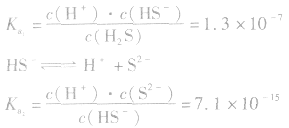
3.影响因素:温度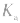 (或
(或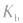 )只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
)只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
4.意义:反映弱酸,弱碱酸碱性的相对强弱在一定温度下, 越大(多元弱酸以
越大(多元弱酸以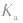 为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
1.概念在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K表示(酸用
 表示,碱用
表示,碱用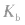 表示)。
表示)。 2.表示方法:
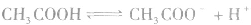
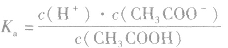
对于多元弱酸,其电离是分步进行的,每步各有电离常数,通常用
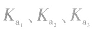 ,等分别表示,且
,等分别表示,且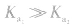
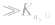
例如:
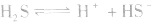
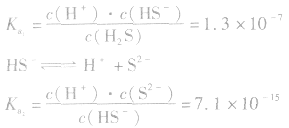
3.影响因素:温度
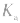 (或
(或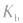 )只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
)只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.4.意义:反映弱酸,弱碱酸碱性的相对强弱在一定温度下,
 越大(多元弱酸以
越大(多元弱酸以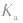 为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。 发现相似题
与“在18℃时,H2SO3的K1=1.5×10-2、K2=1.0×10-7,H2S的K1=9.1×10-...”考查相似的试题有:
- 氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。(1)不能通过电解纯净的液态HF获得F2,其原因是_________________;...
- 如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制...
- 25℃时,在0.5L 0.2mol·L-1的HA溶液中,有 0. 01mol的HA电离成离子。求该温度下HA的电离平衡常数和电离度。
- 下列说法正确的是[ ]A.电离平衡常数受溶液浓度的影响B.电离平衡常数可以表示弱电解质的相对强弱C.电离常数大的酸溶液中c(H...
- 已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=②25℃时,mol·...
- 北京奥运会“祥云”火炬燃料是阿烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。(1)丙烷脱氢可得丙烯已知C3H8(g)=CH4(g)+HC=CH...
- 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。若在恒温、恒压条件下向平衡体系中通入氯气,平衡_________移...
- 关于水的离子积常数Kw与水的电离平衡常数Kc的叙述中,正确的是[ ]A.Kw和Kc都随温度的升高而增大B.Kw和Kc数值不同,但单位相...
- 化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法...
- 在18℃时,H2SO3的K1=1.5×10-2、K2=1.0×10-7,H2S的K1=9.1×10-8、K2=1.1×10-12,则下列说法中正确的是[ ]A.亚硫酸的酸性弱于...