本试题 “人体血液的正常pH约为7.35~7. 45,若在外界因素作用下突然发生改变就会引起“酸中毒” 或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:H...” 主要考查您对弱电解质电离的影响因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质电离的影响因素
电离平衡的影响因素:
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:
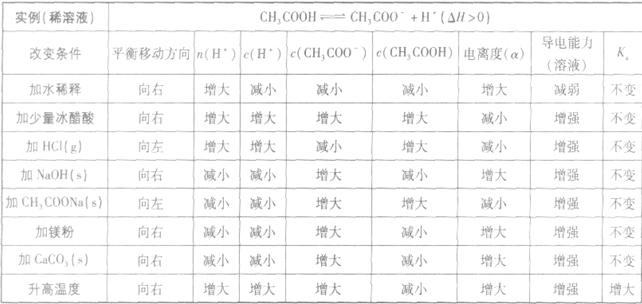
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:

发现相似题
与“人体血液的正常pH约为7.35~7. 45,若在外界因素作用下突然发...”考查相似的试题有:
- 下列事实不能说明亚硝酸是弱电解质的是A.NaNO2溶液的pH大于7B.向HNO2溶液中加入NaNO2固体,溶液的PH变大C.常温下0.1mol/LH...
- 下列叙述正确的是 ( )A.0.1 mol·L-1CH3COOH溶液加水稀释,溶液中所有离子浓度均减小B.常温下,在由水电离出的c(OH-)=1×10...
- (14分)元素及其化合物在生产、生活中具有广泛的用途。Ⅰ.铬化学丰富多彩:⑴在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。...
- 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)...
- 下列事实中,能证明硫酸是强酸的是A.1 mol/L 硫酸溶液中H+浓度为2 mol/LB.能跟锌反应产生氢气C.能使石蕊试液变红D.能与碳...
- 对于弱酸,在一定温度下达到电离平衡时,各粒子的浓度存在一种定量的关系.若25℃时有HAH++A-,则K=式中:K为电离平衡常数...
- 下列物质在水溶液中,存在电离平衡的是A.NaOHB.CH3COOHC.BaSO4D.CH3COONa
- 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。实验一 配制并标定醋酸溶液的浓度取冰醋酸配制250 mL 0.2 mol·L...
- 把1 L 0.1 mol/L醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是 ( )A.c(CH3COOH)变为原来的1/10B.c(H+)变为原来的1/10C.c...
- 常温下,向20.00 mL 0.1000 mol·L-1CH3COONa溶液中逐滴加入0.1000 mol·L-1盐酸,混合溶液的pH与所加盐酸体积的关系如图所示...