本试题 “钢铁工业是国家工业的基础。(1)下图是教材中炼铁高炉及炉内化学变化过程示意图, 根据图示回答下列问题。 若下图中采用的铁矿石的主要成分为氧化铁,请写 出A...” 主要考查您对一氧化碳还原氧化铁
金属的冶炼(铁的冶炼)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 一氧化碳还原氧化铁
- 金属的冶炼(铁的冶炼)
氧化铁自身具有氧化性,我们可以用一氧化碳还原氧化铁。
灼热的氧化铁可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铁+X(氧化物)。
实验室一氧化碳还原氧化铁:
①反应原理:3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 ②装置:
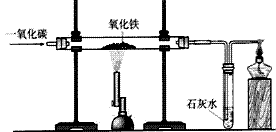
③现象:红色粉末逐渐变为黑色;澄清石灰石变浑浊,尾气燃烧时产生蓝色火焰。
④实验步骤:
a.检验装置的气密性
b.装入药品并固定装置
c.通入一氧化碳气体并点燃酒精灯
d.待装置内的空气全部排尽后点燃酒精喷灯给氧化铁加热
e.当试管内的红色粉末变为黑色时,停止加热
f.待玻璃管内的固体冷却后,停止通一氧化碳,并熄灭酒精灯
⑤实验结论:红色的氧化铁被一氧化碳还原成单质铁,一氧化碳在高温条件下得到了氧,生成了二氧化碳。
⑥化学反应方程式:
3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 CO2+Ca(OH)2==CaCO3↓+H2O
2CO+O2
 2CO2
2CO2⑦注意事项:
a.反应条件:高温;若无洒粉喷灯可在酒精灯火焰上加一个金属网罩。
b.CO有剧毒,实验应在通风橱中进行,未反应完的气体要进行尾气处理;尾气处理方法有收集法、燃烧法(将CO转变为无毒的CO2)以防止污染空气。
c.操作顺序:CO要“早出晚归”,洒精喷灯要“迟到早退”。
实验开始先通入CO,排尽装置内的空气,防止CO 与空气混合,加热时发生爆炸;实验完毕后要继续通入 CO气体,直到玻璃管冷却,防止高温下的铁与空气接触,被氧化。
金属冶炼:
金属冶炼是把金属从化合态变为游离态的过程
矿石
①工业上能用来提炼金属的矿物叫做矿石。
②常见的矿石赤铁矿(Fe2O3)、黄铁矿(FeS2)、褐铁矿(Fe2O3·xH2O)、水铝石(Al2O3·H2O)、菱铁矿(主要成分是FeCO3)、磁铁矿(Fe3O4)、方铅矿(PbS)、孔雀石 [Cu2(OH)2CO3]、赤铜矿(Cu2O)、铝土矿(主要成分是Al2O3)、黄铜矿(主要成分是CuFeS2)、辉铜矿(主要成分是Cu2S)。
铁的冶炼
①原理:把铁矿石冶炼成铁是一个复杂的过程,其主要的反应原理是:
在高温下,利用还原剂一氧化碳把铁从铁矿石里还原出来,其反应的化学方程式是: Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
②炼铁的原料及作用:
铁矿石:提供原料
焦炭:提供能量,产生还原剂
石灰石:将矿石中的二氧化硅转变为炉渣。
③设备:高炉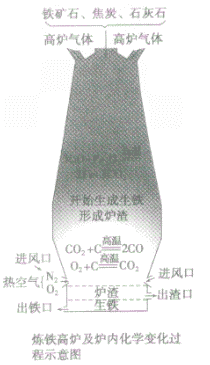
④高炉内有关反应:
a.产生CO提供能量:C+O2 CO2;CO2+C
CO2;CO2+C 2CO
2CO
b.在高温下用CO将Fe从Fe2O3中还原出来:3CO+ Fe2O3 2Fe + 3CO2
2Fe + 3CO2
c.用石灰石将矿石中的SiO2转变为炉渣除去。
CaCO3 CaO+CO2↑,CaO+SiO2
CaO+CO2↑,CaO+SiO2 CaSiO3
CaSiO3
⑤产品:生铁
炼铁高炉中出铁口低于出渣口的原因:
炼铁高炉中出铁口与出渣口的高低取决于铁水和炉渣的密度〔铁水的密度大于炉渣的密度)。
金属的冶炼方法:
①热分解法(适用于Hg,Ag不活泼的金属的冶炼,加热使其氧化物分解) 如:
2HgO=Hg+O2↑
②热还原法(适用于金属活动性顺序表中,Zn- Cu金属的冶炼)
a.用H2作还原剂(优点:制得金属纯度高,污染小) 如:Fe3O4+4H2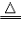 3Fe+4H2O
3Fe+4H2O
b.用焦炭、一氧化碳作还原剂(易混入杂质,污染大气,适合工业化大规模生产) 如:
炼铁的反应方程式为Fe2O3+3CO 2Fe +3CO2
2Fe +3CO2
炼锌的反应万程式为2ZnO+C 2Zn+CO2↑
2Zn+CO2↑
c.用Al作还原剂(铝热剂用来焊接铁轨) 如:
8Al+3Fe3O4 9Fe+4Al2O3
9Fe+4Al2O3
d.电解法(适用于活泼金属Na,Mg等的冶炼) 如:
2NaCl(熔融) 2Na+Cl2↑ ;MgCl2(熔融)
2Na+Cl2↑ ;MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
e.湿法冶金(从溶液中通过化学反应来获取金属) 如:
Fe+CuSO4==Cu+FeSO4
金属冶炼是把金属从化合态变为游离态的过程
矿石
①工业上能用来提炼金属的矿物叫做矿石。
②常见的矿石赤铁矿(Fe2O3)、黄铁矿(FeS2)、褐铁矿(Fe2O3·xH2O)、水铝石(Al2O3·H2O)、菱铁矿(主要成分是FeCO3)、磁铁矿(Fe3O4)、方铅矿(PbS)、孔雀石 [Cu2(OH)2CO3]、赤铜矿(Cu2O)、铝土矿(主要成分是Al2O3)、黄铜矿(主要成分是CuFeS2)、辉铜矿(主要成分是Cu2S)。
铁的冶炼
①原理:把铁矿石冶炼成铁是一个复杂的过程,其主要的反应原理是:
在高温下,利用还原剂一氧化碳把铁从铁矿石里还原出来,其反应的化学方程式是: Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2 ②炼铁的原料及作用:
铁矿石:提供原料
焦炭:提供能量,产生还原剂
石灰石:将矿石中的二氧化硅转变为炉渣。
③设备:高炉

④高炉内有关反应:
a.产生CO提供能量:C+O2
 CO2;CO2+C
CO2;CO2+C 2CO
2COb.在高温下用CO将Fe从Fe2O3中还原出来:3CO+ Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 c.用石灰石将矿石中的SiO2转变为炉渣除去。
CaCO3
 CaO+CO2↑,CaO+SiO2
CaO+CO2↑,CaO+SiO2 CaSiO3
CaSiO3⑤产品:生铁
炼铁高炉中出铁口低于出渣口的原因:
炼铁高炉中出铁口与出渣口的高低取决于铁水和炉渣的密度〔铁水的密度大于炉渣的密度)。
金属的冶炼方法:
①热分解法(适用于Hg,Ag不活泼的金属的冶炼,加热使其氧化物分解) 如:
2HgO=Hg+O2↑
②热还原法(适用于金属活动性顺序表中,Zn- Cu金属的冶炼)
a.用H2作还原剂(优点:制得金属纯度高,污染小) 如:Fe3O4+4H2
 3Fe+4H2O
3Fe+4H2O b.用焦炭、一氧化碳作还原剂(易混入杂质,污染大气,适合工业化大规模生产) 如:
炼铁的反应方程式为Fe2O3+3CO
 2Fe +3CO2
2Fe +3CO2炼锌的反应万程式为2ZnO+C
 2Zn+CO2↑
2Zn+CO2↑ c.用Al作还原剂(铝热剂用来焊接铁轨) 如:
8Al+3Fe3O4
 9Fe+4Al2O3
9Fe+4Al2O3 d.电解法(适用于活泼金属Na,Mg等的冶炼) 如:
2NaCl(熔融)
 2Na+Cl2↑ ;MgCl2(熔融)
2Na+Cl2↑ ;MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑ e.湿法冶金(从溶液中通过化学反应来获取金属) 如:
Fe+CuSO4==Cu+FeSO4
发现相似题
与“钢铁工业是国家工业的基础。(1)下图是教材中炼铁高炉及炉内化...”考查相似的试题有:
- 如图是课堂中模拟炼铁的实验装置(1)实验过程中,先要进行的是_________(填Ⅰ或Ⅱ)Ⅰ.加热Ⅱ.通一氧化碳,其目的是_________...
- 下图为实验室用一氧化碳还原氧化铁的实验装置图,两位同学在老师的指导下按下图连接实验装置、检查装置的气密性、装药品、固...
- 钢铁工业是国家工业的基础。(1)下图是教材中炼铁高炉及炉内化学变化过程示意图, 根据图示回答下列问题。 若下图中采用的铁矿...
- 下列叙述中不正确的是( )A.该反应中一氧化碳是还原剂B.发生氧化反应的是氧化铜C.实验前要先通入一氧化碳,再点燃酒精灯D...
- 用“增大”、“不变”、“低”、“降低”完成下列填空(1)向稀硝酸铵溶液中加入适量硝酸铵晶体后,溶液的温度______、溶液质量______...
- 如图,是铁矿石冶炼、铁生锈、及除锈的主要流程,请按要求回答问题:(1)铁生锈的条件是______(2)写出有关化学反应方程式①...
- 人类的生活和生产都离不开金属材料.(1)铁生锈的条件是:铁与空气和 直接接触.(2)根据铁生锈的条件,自行车支架采取的防...
- 小华家有一张铁床,因长期受潮已锈迹斑斑。他从上面取一枚生锈的铁螺丝放入一定量的稀硫酸中,观察到铁锈(主要成分是Fe2O3)逐...
- 已知某金属X有下列相关信息:①它的主要矿物的化学成分是X2O3;②它主要通过热还原法冶炼而成;③它的年产量位于金属之首.(1)...
- 铜和铁是生产、生活中广泛使用的金属.(1)下图是工业炼铁原理的实验示意图.气体A是______和红棕色粉末B是______.广口瓶中...