本试题 “已知MnO2与浓盐酸可以发生如下反应:4HCl(浓)+MnO2 △ . MnCl2+Cl2↑+2H2O,若产生标准状况下2.24L氯气,求:(1)反应过程中转移电子的物质的量为多少?(2...” 主要考查您对化学反应方程式
氧化还原反应的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式
- 氧化还原反应的计算
化学方程式:
用化学式来表示化学反应的式子,叫做化学方程式。化学方程式不仅表明了反应物、生成物和反应条件,同时,通过相对分子质量或相对原子质量还可以表示个物质之间的质量关系,即各物质之间的质量比。
书写化学方程式要遵守两个原则:
一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;
二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等。
化学方程式的意义:
化学方程式不仅表明了反应物、生成物和反应条件。同时,化学计量数代表了各反应物、生成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质量关系,即各物质之间的质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如

5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
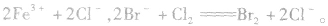 。
。
与“已知MnO2与浓盐酸可以发生如下反应:4HCl(浓)+MnO2 △ . MnC...”考查相似的试题有:
- 多原子分子的性质与卤素单质相似,故称它们为类卤素化合物,它们可以生成酸和盐,见下表:(表中X代表F、Cl、Br、I)(1)在表...
- 由锌.铁.铝.镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有...
- 下列表示溶液中发生反应的化学方程式错误的是[ ]A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑B.2KMnO4+HCOOK+ KOH=2K2MnO4+CO2↑+H2OC.D...
- 4.35g二氧化锰能与浓盐酸(密度为1.19g•cm-3、质量分数为36.5%)完全反应.求:(1)盐酸中HCl的物质的量浓度.(2)被氧化的...
- 80℃,101kPa下,用如图装置进行如下实验。A、C两筒内分别装有无色气体,它们可能是NH3、O2、N2、H2S、NO、CO2等气体,B筒内装有Na2O2...
- 盐酸和氢氧化钠溶液恰好完全中和时,一定相等的是( )A.体积B.H+和OH-的物质的量C.质量D.物质的量浓度
- 实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量...
- 某浓度的硝酸与过量的铁粉反应生成标准状况下N2O气体4.48L.若改用铝粉反应(生成NO气体),则最终可溶解铝粉的质量为( )A...
- 在氧化还原反应的过程中,氧化反应和还原反应同时发生,有关SO2+2H2O →SO42-+4H++2e-反应的说法错误的是[ ]A.该反应为...
- 30mL0.05mol/LNa2SO3溶液恰好与50mL0.02mol/LKXO4溶液完全反应转化为Na2SO4.则X元素在产物中的化合价是( )A.+2B.+3C.+4...