本试题 “FeCl3广泛用于净水、制印刷电路等方面.下列各组物质能直接反应用来制取FeCl3的是( )A.Fe与盐酸B.Fe2O3与盐酸C.BaCl2与FeSO4D.FeCO3与盐酸” 主要考查您对复分解反应
金属的化学性质
物质的相互转化和制备
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 复分解反应
- 金属的化学性质
- 物质的相互转化和制备
复分解反应:
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
| 规律 | 发生的条件 |
| 金属氧化物+酸 | 生成物中有水,一般都能反应 |
| 酸+碱→盐+水 | 中和反应,有水生成,一般都能反应 |
| 酸+盐→新酸+新盐 | 生成物种有沉淀,气体或水 |
| 碱+盐→新碱+新盐 | 生成物种有沉淀,气体或水 |
| 盐1+盐2→新盐1+新盐2 | 生成物种有沉淀 |
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
金属的化学性质:
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
2.金属与酸的反应
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
| 金属 | 在空气中 | 在氧气中 | 方程式 |
| 镁 | 常温下表面逐渐变暗。点燃 剧烈燃烧,发出耀眼的白光, 生成白色固体 |
点燃,剧烈燃烧,发出耀 眼的白光,生成白色固体 |
2Mg+O2 2MgO 2MgO |
| 铝 | 常温下,铝表而变暗,生成一 层致密氧化膜,保护铝不再被腐蚀 |
点燃。剧烈燃烧,火星四射, 放出大量的热,生成白色固体 |
4Al+3O2 2Al2O3 2Al2O3 |
| 铁 | 持续加热发红,离火变冷 | 火星四射,放出大量的热, 生成黑色固体 |
3Fe+2O2 Fe3O4 Fe3O4 |
| 铜 | 加热,生成黑色物质,在潮湿的 空气中,生成铜绿而被腐蚀 |
加热,生成黑色固体 | 2Cu+O2 2CuO 2CuO |
| 金 | 即使在高温也不和氧气反应 | —— | |
| 结论 | 大多数金属都能喝氧气反应,但反应的难易程度和剧烈程度不同 | ||
2.金属与酸的反应
| 盐酸 | 稀硫酸 | 反应现象(两种酸中相同) | |
| 镁 | Mg+2HCl==MgCl2+H2↑ | Mg+H2SO4==MgSO4+H2↑ | 反应比较剧烈,产生大量 气泡,溶液仍为无色,生成 的气体能够燃烧,并且产 生淡蓝色火焰 |
| 铝 | 2Al+6HCl==2AlCl3+3H2↑ | 2Al+3H2SO4==Al2(SO4)+3H2↑ | |
| 锌 | Zn+2HCl==H2↑+ZnCl2 | Zn+H2SO4==ZnSO4+H2↑ | 反应缓慢,有气泡产生,溶 液由无色逐渐变为浅绿色, 生成的气体能够燃烧,并且 产生淡蓝色火焰 |
| 铁 | Fe+2HCl==FeCl2+H2↑ | Fe+H2SO4==FeSO4+H2↑ | |
| 铜 | 不反应 | 不反应 | 无 |
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
| CuSO4溶液 | AgNO3溶液 | NaCl溶液 | |
| 锌 | 锌表面有一层红色金属析出,溶液由蓝色变为无色 Zn+CuSO4==ZnSO4+Cu |
锌表面有一层银白色金属析出 Zn+2AgNO3==Zn(NO3)2+2Ag |
无变化,不反应 |
| 铁 | 铁表面有一层红色金属析出,溶液由蓝色变为浅绿色 Fe+CuSO4==FeSO4+Cu |
铁表面有一层银白色金属析出,溶液由无色变为浅绿色 Fe+2AgNO3==Fe(NO3)2+2Ag |
无变化,不反应 |
| 铜 | 无变化,不反应 | 铜表面有一层银白色金属析出,溶液由无色变为蓝色 Cu+2AgNO3==Cu(NO3)2+2Ag |
无变化,不反应 |
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
物质的相互转化和制备:
主要是指以氧气、氢气、碳、硫、磷等为代表的非金属单质,以铝、镁、锌、铁、铜为代表的金属单质,以一氧化碳、二氧化碳等为代表的非金属氧化物,以氧化铜、氧化铁等为代表的金属氧化物,以盐酸、硫酸、碳酸等为代表的酸,以氢氧化钠、氢氧化钙等为代表的碱,以氯化钠、碳酸钠、碳酸氢钠、碳酸钙等为代表的盐,等等物质之间的相互和制备.
物质的相互转化:
氢氧化钠与氢氧化钙的制备:
(1)NaOH的制备
方法一:Na2O+H2O==2NaOH
方法二:Na2CO3+Ca(OH)2==CaCO3↓ +2NaOH
(2)Ca(OH)2的制备方法:CaO+H2O==Ca(OH)2
常见物质的相互转化:
Na→Na2O→NaOH→Na2CO3
C→CO→CO2→H2CO3
Fe→Fe2O3→Fe2(SO4)3→Fe(OH)3→FeCl3
S→SO2→SO3→H2SO4(单质硫不能直接转化为SO3)
各类物质间的转化关系:
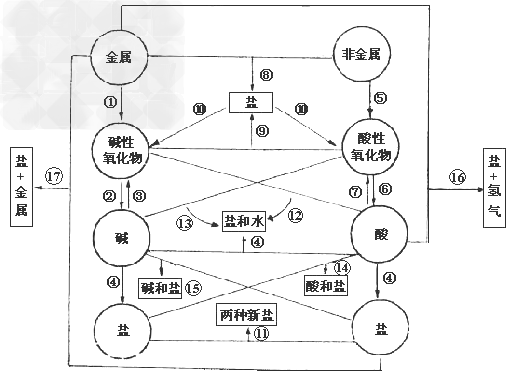
(1)金属+
 金属氧化物(碱性氧化物)
金属氧化物(碱性氧化物) 
(2)碱性氧化物(可溶)+水
 碱(可溶)
碱(可溶)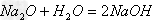
(3)碱(难溶)
 碱氧(难溶)+水
碱氧(难溶)+水 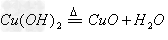
(4)酸+碱
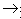 盐+水
盐+水 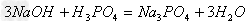 ;
;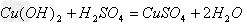
(5)非金属+
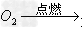 非金属氧化物(酸性氧化物)
非金属氧化物(酸性氧化物)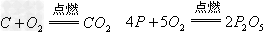
(6)酸性氧化物(易溶)+水
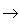 酸(易溶)
酸(易溶)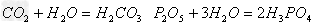
(7)酸(易挥发/难溶)
 酸氧+水(易挥发/难溶)
酸氧+水(易挥发/难溶) 
从纵向来看,金属
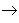 碱性氧化物
碱性氧化物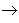 碱
碱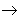 盐,其中金属元素相同。
盐,其中金属元素相同。非金属
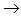 酸性氧化物
酸性氧化物 酸(含氧酸)
酸(含氧酸) 盐,其中非金属元素相同。
盐,其中非金属元素相同。横向:
(8)金属+非金属(无氧酸)
 盐
盐 
(9)碱氧+酸氧(含氧酸)
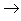 盐
盐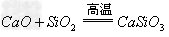
(10)含氧酸盐
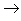 碱氧+酸氧
碱氧+酸氧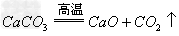
(11)盐+盐
 两种新盐
两种新盐 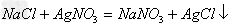
交叉:
(12)酸+碱氧
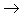 盐+水
盐+水
(13)碱+酸氧
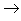 盐+水
盐+水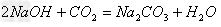
(14)酸+盐
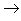 新酸+新盐
新酸+新盐 ;
;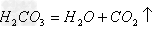
(15)碱+盐
 新碱+新盐
新碱+新盐
(16)金属+酸
 盐+
盐+
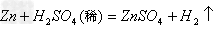
(17)金属+盐
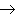 新盐+新金属
新盐+新金属(18)金属+盐
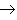 新盐+新金属
新盐+新金属 (置换反应)
(置换反应) 发现相似题
与“FeCl3广泛用于净水、制印刷电路等方面.下列各组物质能直接反...”考查相似的试题有:
- 写出下列反应的化学方程式,并注明反应的基本类型⑴红磷在空气中燃烧:(___________________)、(____)⑵用铁除去硫酸亚铁溶...
- 请回答下列有关硫酸知识的问题:(1)实验室用浓硫酸(溶质质量分数为98%,密度为1.84g/cm3)配制300g溶质质量分数11%的稀硫...
- 关于化学反应A+B===C+D。下列说法中正确的是[ ]A. 若生成物C和D分别是盐和水,则反应物一定是酸和碱B. 若A. B. C和D都是化合...
- 生活中处处有化学,请用所学知识回答下列问题。(1)铝制餐具比铁制餐具更耐腐蚀,原因是__________________________。(2)硝酸...
- 向AgNO3、Cu(NO3)2的混合溶液中加入一些铁粉,完全反应后过滤。不可能存在的情况是A.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+B...
- 我们的生活与化学密切相关.请你针对下面生活中的问题填空.(1)日常生活中,用于铁栏杆外层涂料的“银粉”大多是金属______(...
- 把A、B两块质量相等的铁片分别放进盛有等质量,等质量分数的盐酸和硫酸的两个烧杯中,两烧杯分别放在一天平的左右两个托盘上...
- 下图分别与相应的操作过程相对应,其中正确的是[ ]A.向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体(不考虑温度变化)B....
- 向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,过滤。则下列情况中可能出现的是 ①滤液中有Ag+...
- 为了初步确定某种铁矿石的种类,取该铁矿石用盐酸溶解,有气体放出,这种铁矿石的名称是[ ]A.磁铁矿B.赤铁矿C.菱铁矿D.大理石