本试题 “有A、B、C、D、E、F六种元素,已知:①它们位于三个不同短周期,核电荷数依次增大 ②B与F同主族.③B、C分别都能与D按原子个数比1:1或1:2形成化合物.④A、E分...” 主要考查您对物质性质的研究
化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质性质的研究
- 化学反应热的计算
研究对象:
物质的物理性质、化学性质物质性质。
研究方法:
观察与问题、假设与预测、实验与事实、解释与结论、表达与交流、扩展与迁移。
应用盖斯定律进行计算的方法:
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
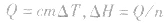
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
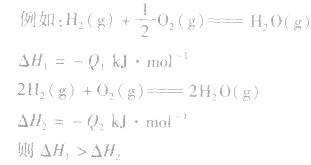
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即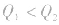 .
.
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
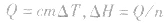
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
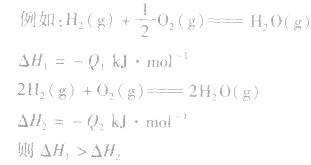
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
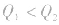 .
. 发现相似题
与“有A、B、C、D、E、F六种元素,已知:①它们位于三个不同短周期...”考查相似的试题有:
- 阅读下列信息:Ⅰ、表中①~⑥为短周期元素及相应氢化物沸点的数据:元素性质元素编号①②③④⑤⑥氢化物的沸点(℃)-60.7-33.4100-87....
- A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族.C原子核内质子数等于A、B原子核内...
- X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,且XZ2与...
- 元素在周期表中的位置,反映了元素的原子结构和性质.下列说法正确的是( )A.处于元素周期表金属和非金属分界线附近的为过...
- 2010年沭阳采用网上阅卷,答题时要求使用2B铅笔填涂答题卡.铅笔芯的主要成分是( )A.石墨B.金刚石C.二氧化锰D.铅
- 某元素的3p能级上有两个未成对电子,因此其( )A.第三电子层上有4个电子B.最高正价为+6C.最高正价为+4D.是非金属元素
- 填空并写出下列反应的热化学方程式:(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量...
- 由氢气和氧气反应生成4.5g水蒸气放出热60.45kJ,则反应:2H2(g)+O2(g)2H2O(g)的△H为( ) A.-483.6kJ•mol-1 B.-241.8...
- 在101KPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。已知C(石墨)、H2和CO的燃烧热分别为393....
- 已知反应:① 2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol下列说法正...