本试题 “已知反应:① 2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol下列说法正确的是[ ]A.碳的燃烧热是110.5 kJ...” 主要考查您对化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应热的计算
应用盖斯定律进行计算的方法:
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
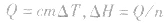
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
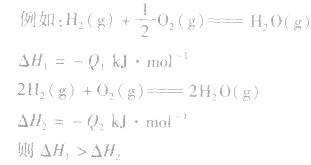
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即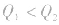 .
.
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
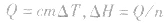
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
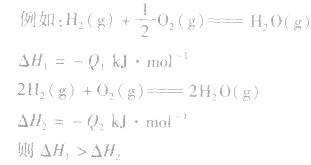
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
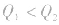 .
. 发现相似题
与“已知反应:① 2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol② 稀溶...”考查相似的试题有:
- 根据碘与氢气反应的热化学方程式:H2(g)+I2(g)2HI(g)ΔH=–26.48kJ/mol①H2(g)+I2(s)2HI(g)ΔH=+9.48kJ/mol ②下...
- 已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,并放出XkJ热量。已知单质碳的燃烧热为YkJ/mol,则1molC与O2反应生成CO的反应热...
- 由氢气和氧气反应生成4.5g水蒸气放出热60.45kJ,则反应:2H2(g)+O2(g)2H2O(g)的△H为( ) A.-483.6kJ•mol-1 B.-241.8...
- 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol Na2O2(s)+CO2(g)= Na2CO3(s)+1/2O2(g)ΔH =-226kJ/mol 下列表述正确的是(NA代表...
- (1)已知:Zn(s)+S(斜方)=ZnS(s) △H1= -206. 0kJ/mol;ZnS(s)+2O2(g)=ZnSO4(s) △H2= -776. 8kJ/mol。试求由单质反应生成ZnSO4(...
- 由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:___________________。若1g水蒸气转化成液态水放热...
- 用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1②CH4(g)+...
- 已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量. 4P(红,s)+5O2(g)===2P2O5(s) ΔH1 4P(白,s)+5O2(g)===2P2O5(s) ΔH2 ...
- 氢气、一氧化碳、辛烷(C8H18)、甲烷燃烧的热化学方程式分别为:H2(g)+O2(g)=H2O(l);△H=-285.8kJ/molCO(g)+O2(g)...
- 一定条件下各取1L的CH4和C2H6完全燃烧,分别放出227. 3kJ和394. 7kJ热量。现有甲烷和乙烷混合气体 1L在相同条件下完全燃烧放...