本试题 “某课外小组对一些金属单质和化合物的性质进行研究。(1)下表为“铝与氯化铜溶液反应”实验报告的一部分按反应类型写出实验中发生反应的化学方程式各一个(是离子...” 主要考查您对单质铝
氢氧化铝
铝盐(铝离子)
单质铜
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铝
- 氢氧化铝
- 铝盐(铝离子)
- 单质铜
铝的主要性质:
- 物理性质:
铝是银白色,具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。 - 化学性质:
活泼金属,具有较强的还原性;常温下铝在浓硫酸和浓硝酸中发生钝化;既可以与酸反应又可以与碱反应。
(1)与氧气反应: (纯氧中发出耀眼的白光)
(纯氧中发出耀眼的白光)
(2)与Cl2 、S 、N2反应: (Al2S3在溶液中完全双水解)
(Al2S3在溶液中完全双水解)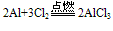
 (AlN与水反应生成Al(OH)3和NH3↑)
(AlN与水反应生成Al(OH)3和NH3↑)
(3)与水反应: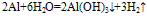
(4)与酸反应: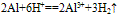
(5)与碱的反应:
(6)铝热反应:2Al+Fe2O3=(高温)=Al2O3+2Fe - 铝的用途
纯铝制作导线,铝合金用于制造飞机、汽车、生活用品等。
铝的特殊性质:
铝既能与酸反应,也能与强碱反应。
铝与酸反应:铝与浓硫酸在常温下发生钝化,2Al+6HCl==2AlCl3+3H2↑
铝与碱反应:2Al+2NaOH+2H2O==2NaAlO2+3H2↑
铝热反应:
铝热法是一种利用铝的还原性获得高熔点金属单质的方法。此种反应被称为铝热反应。
可简单认为是铝与某些金属氧化物(如Fe2O3、Fe3O4、Cr2O3、V2O5等)或非金属氧化物(如SiO2等)在高热条件下发生的反应。
铝热反应常用于冶炼高熔点的金属,并且它是一个放热反应,
其中镁条为引燃剂,氯酸钾为助燃剂。
其装置如下图所示: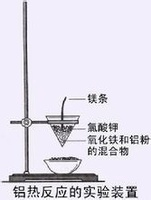
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,然后便可得到Al为8,Fe为9。
镁铝的化学性质比较:
| 单质 | 镁 | 铝 |
| 与非金属反应 | 2Mg+O2=(点燃)=2MgO (发出耀眼白光) Mg+Cl2=(点燃)=MgCl2 3Mg+N2=(点燃)=Mg3N2 |
4Al+3O2=(加热)=2Al2O3 2Al+3Cl2=(加热)=2AlCl3 2Al+3S=(加热)=Al2S3 |
| 与沸水反应 | Mg+2H2O=(加热)=Mg(OH)2+H2↑ | 不反应 |
| 与酸反应 | Mg+2H+==Mg2++H2↑ 与稀硝酸反应生成Mg(NO3)2、NOx(或者N2、NH4NO3)、H2O |
2Al+6H+==2Al3++3H2↑ 在冷的浓硝酸或浓硫酸中钝化 |
| 与氧化物反应 | 2Mg+CO2=(点燃)=2MgO+C (剧烈燃烧,生成白色粉末和黑色固体) |
2Al+Fe2O3=(高温)=2Fe+Al2O3(铝热反应) |
| 与盐溶液反应 | Mg+2NH4++2H2O==Mg2++2NH3·H2O+H2↑ Mg+Cu2+==Mg2++Cu |
2Al+3Hg2+=2Al3++3Hg |
| 与强碱反应 | 不反应 | 2Al+2OH-+2H2O==2AlO2-+3H2↑ |
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,底下便可得到Al为8,Fe为9。
铝与酸、碱反应的计算技巧:
铝与酸、碱反应的实质都是 ,
, ,所以根据得失电子守恒可知:
,所以根据得失电子守恒可知: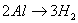 ,利用此关系可以方便地进行有关计算。
,利用此关系可以方便地进行有关计算。
铝与酸或碱溶液反应生成H2的量的计算:
Al是我们中学阶段学习的唯一既与H+反应也与OH-反应的金属,它与酸、碱反应既有相同点,也有不同点。
相同点:Al均被氧化成+3价,所以1molAl不论与H+还是与OH-反应均生成3gH2。
不同点:1molAl与H+反应消耗3molH+,而与OH-反应只消耗1molOH-,所以含有等物质的量的NaOH溶液和HCl溶液分别与足量的铝反应时生成的氢气的物质的量之比为3∶1。

“铝三角”关系:
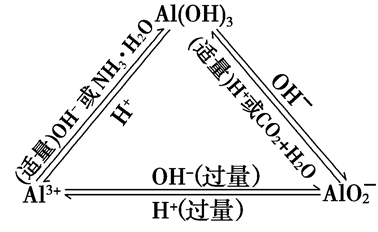
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
钝化:
铝、铁在常温下与浓硫酸发生钝化,钝化不是不反应,而是被氧化成一层致密的氧化物薄膜,恰恰说明金属的活泼性。
氢氧化铝的性质:
不溶于水的白色胶状物质;能凝聚水中的悬浮物,可用作净水剂、可治疗胃酸过多、作糖的脱色剂等;既能与酸反应,又能与碱反应。
(1)与酸反应:Al(OH)3+3H+==Al3++3H2O
(2)与碱反应:Al(OH)3+OH-==AlO2-+2H2O
氢氧化铝的性质:
- 氢氧化铝是一种白色不溶于水的胶状沉淀,它能凝聚水中的悬浮物,并能吸附色素。
- 氢氧化铝既能与强酸反应也能与强碱反应,是两性氢氧化物。
- 氢氧化铝是医用的胃酸中和剂的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,是胃液酸度降低,起到中和过多胃酸的作用。
- 氢氧化铝受热是分解成氧化铝和水。2Al(OH)3=(加热)=Al2O3+3H2O
氢氧化铝的制备:
实验室制法:Al2(SO4)3+6NH3·H2O==(NH4)2SO4+Al(OH)3↓
其他制法:①AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
②2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
③AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
④3AlO2-+Al3++6H2O==4Al(OH)3↓
例题:用稀H2SO4、NaOH溶液和金属铝为原料制取Al(OH)3。
甲、乙、丙三个学生的制备途径分别是
甲:
乙: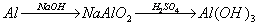
丙: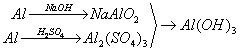
若要得到等量的Al(OH)3,则( B )
A.三者消耗的原料相同 B.甲消耗的原料的总物质的量最多 C.乙消耗的原料的总物质的量最少 D.丙消耗的原料的总物质的量最多
有关Al(OH)3的计算及图象分析:
解答有关Al(OH)3的图象和计算问题要注意以下三点:
(1)“铝三角”关系图中各物质转化方程式中的化学计量数关系。
(2)铝元素的存在形式。
(3)图象分析时:首先要看清横、纵坐标的含义,其次要对图象进行全面的分析,尤其需要关注的是特殊点(起点、折点、顶点、终点)的含义。
1、铝盐与强碱溶液作用生成Al(OH)3沉淀的计算
反应关系如下:
(1)Al3++3OH-==Al(OH)3(生成沉淀)
(2)Al(OH)3+OH-==AlO2-+2H2O(沉淀溶解)
(3)Al3++4OH-==AlO2-+2H2O(生成沉淀,又恰好溶解)
分析以上三个化学反应方程式,所得Al(OH)3沉淀的物质的量与n(Al3+)、n(OH-)的关系为:
当 ≤3时,所得沉淀的物质的量:n[Al(OH)3]=
≤3时,所得沉淀的物质的量:n[Al(OH)3]=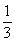 n(OH-)
n(OH-)
当 ≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
当3< <4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)
<4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)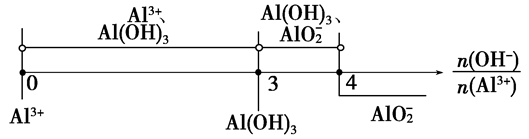
2、有关Al(OH)3的图像分析
①向 溶液中滴加
溶液中滴加 溶液
溶液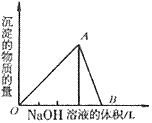
O~A段: 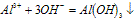
A~B段: 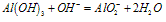
②向强碱溶液中滴入铝盐溶液 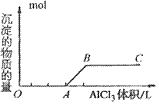
O~A段: 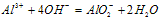
A~B段: 
③向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液
A. 向铝盐中滴加氨水时,当氨水增加到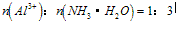 时,产生最大沉淀量
时,产生最大沉淀量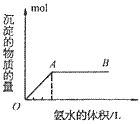
B. 向氨水中滴加铝盐溶液时,开始时氨水过量,如图所示 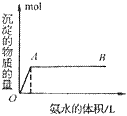
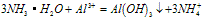
分析得:氢氧化铝不溶于弱碱氨水中。
④向偏铝酸盐溶液中滴入强酸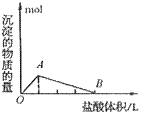
O~A段:
O~B段:
⑤向盐酸中滴加偏铝酸盐溶液 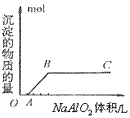
O~A段: 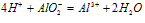
A~B段: 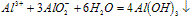
方法与技巧:
- 利用互滴顺序不同,现象不同可检验的溶液
(1)AlCl3溶液和盐酸
(2)NaAlO2溶液和盐酸
(3)Na2CO3溶液和盐酸
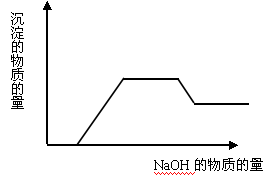
(4)AgNO3溶液和氨水 - 当溶液中有多种离子时,要考虑离子之间的反应顺序,如向含有H+、NH4+、Mg2+、Al3+的混合溶液中逐滴加入NaOH溶液,NaOH先与H+反应,再与Mg2+、Al3+反应生成沉淀,再与NH4+反应,最后才溶解Al(OH)3沉淀。一般是按生成水、沉淀、气体的顺序反应。可用图像表示为:
- AlO2-与HCO3-的反应不属于水解相互促进的反应,而是HCO3-电离出的H+与AlO2-发生的反应:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
铝盐:
铝盐是指正三价铝离子和酸根阴离子组成的盐,一般来说呈白色或无色晶体,溶于水,个别不溶于水。
常用的铝盐主要有三氯化铝、硫酸铝和明矾。
(1)与碱反应:Al3++3OH-(少量)==Al(OH)3↓
Al3++4OH-(过量)== AlO2-+2H2O
(2)Al3++3AlO2-+6H2O==4Al(OH)3↓
铝盐的性质:
Al3+易水解,显酸性Al3++3H2O==Al(OH)3+3H+
(1)与碱反应:Al3++3OH-(少量)==Al(OH)3↓
Al3++4OH-(过量)==AlO2-+2H2O
(2)易发生双水解:Al3++3AlO2-+6H2O==4Al(OH)3↓
铝盐与强碱溶液作用生成Al(OH)3沉淀的计算
反应关系如下:
(1)Al3++3OH-==Al(OH)3(生成沉淀)
(2)Al(OH)3+OH-==AlO2-+2H2O(沉淀溶解)
(3)Al3++4OH-==AlO2-+2H2O(生成沉淀,又恰好溶解)
分析以上三个化学反应方程式,所得Al(OH)3沉淀的物质的量与n(Al3+)、n(OH-)的关系为:
当 ≤3时,所得沉淀的物质的量:n[Al(OH)3]=
≤3时,所得沉淀的物质的量:n[Al(OH)3]=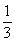 n(OH-)
n(OH-)
当 ≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
当3< <4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)
<4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)
2、有关Al(OH)3的图像分析
①向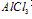 溶液中滴加
溶液中滴加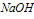 溶液
溶液
O~A段: 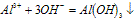
A~B段: 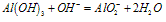
②向强碱溶液中滴入铝盐溶液 
O~A段: 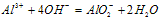
A~B段: 
③向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液
A. 向铝盐中滴加氨水时,当氨水增加到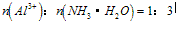 时,产生最大沉淀量
时,产生最大沉淀量
B. 向氨水中滴加铝盐溶液时,开始时氨水过量,如图所示 
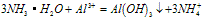
分析得:氢氧化铝不溶于弱碱氨水中。
④向偏铝酸盐溶液中滴入强酸
O~A段:
O~B段: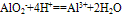
⑤向盐酸中滴加偏铝酸盐溶液 
O~A段: 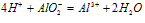
A~B段: 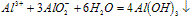
“铝三角”关系:

Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
典型例题解析:
在50mLbmol·L-1的AlCl3溶液中加入50mLamol·L-1NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量为________。
(2)当a、b满足________条件时,无沉淀产生。
(3)当a、b满足________条件时,先有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3的质量为________g。
解析:依题意知,在AlCl3溶液中加入NaOH溶液有如下两个反应发生: AlCl3+3NaOH===Al(OH)3↓+3NaCl ①
AlCl3+4NaOH===NaAlO2+3NaCl+2H2O ②
根据以上两反应可以看出:
(1)当a≤3b时,只发生第一个反应,此时NaOH不足量,产生沉淀的量取决于NaOH。3n[Al(OH)3]=n(NaOH)?。所以答案为0.05a/3mol。
(2)如果无沉淀生成,Al元素全部以AlO2-形式存在。 n(AlCl3)∶n(NaOH)≤1∶4,即a∶b≥4∶1,所以答案为a≥4b。
(3)此种情况应当是两个反应均发生,铝元素以Al(OH)3和AlO2-两种形式存在。符合关系: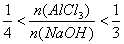 即
即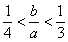 ,整理得:3b<a<4b或
,整理得:3b<a<4b或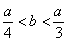 。
。
求沉淀的量的方法很多。
解法一:联立方程法。
设反应①中,AlCl3物质的量为x,则Al(OH)3为x,NaOH为3x。
反应②中AlCl3物质的量为y,NaOH为4y。 
解得x=(0.2b-0.05a)mol=0.05(4b-a)mol。 m[Al(OH)3]=78g·mol-1×0.05(4b-a)mol=3.9(4b-a)g。
解法二:守恒法。此种条件下,溶液中的离子有Na+、Cl-、AlO2-。
n(AlO2-)=n(Na+)-n(Cl-)=0.05amol-0.05×3bmol。
n[Al(OH)3]=n(Al3+)总-n(AlO2-)=0.05bmol-(0.05amol-0.15bmol)=(0.2b-0.05a)mol=0.05(4b-a)mol。
m[Al(OH)3]=78g·mol-1×0.05(4b-a)mol =3.9(4b-a)g。
【答案】 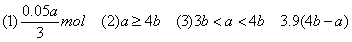
铜元素:
在元素周期表中的位置:铜的原子序数29,位于周期表中第四周期,第IB族。
(1)物理性质:有金属光泽,紫红色固体,密度较大,导电导热性能很好,具有很好的延展性,铜属于重金属、有色金属、常见金属,不能被磁铁吸引。
(2)化学性质: 铜常见的化合价为+1价和+2价
①在加热条件下,铜可与多种非金属单质反应。一般来说,遇到氧化性较弱的非金属,铜显较低化合价;遇到氧化性较强的非金属,铜显较高化合价。例如:与强氧化剂反应(如Cl2 Br2等)生成+2价铜的化合物。如:
Cu+Cl2 CuCl2 2Cu+O2
CuCl2 2Cu+O2 2CuO
2CuO
②铜与酸反应:铜只能被氧化性酸中的中心元素氧化。例如: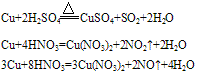
③铜与盐溶液反应:
Cu+2AgCl CuCl2+2Ag
CuCl2+2Ag
铜与铁的对比:
从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au可知,金属铁的金属活性比铜强,所以单质Fe可以从Cu的溶液中还原出单质来,例如: Fe+CuCl2 FeCl2+Cu
FeCl2+Cu
即Fe的还原性强于Cu
铜与浓硫酸和稀硫酸的反应:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O
2CuSO4+2H2O
注意:从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au 可知,铜不能与稀硫酸发生反应,但是在有氧气和加热的条件下可以反应
铜与铜的化合物之间的转换图: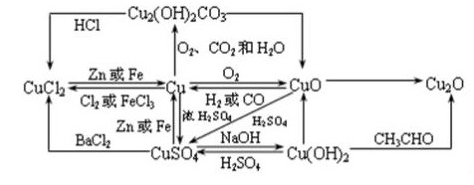
铜的制备和精炼:
(1)工业炼铜法:CuO+CO Cu+CO2
Cu+CO2
(2)湿法炼铜:Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
(3)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
备注:粗铜中铜的的含量为99.5%-99.7%,主要含有Ag、Zn、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%-99.98%的铜,原理为用粗铜作阳极,失去电子变为Cu2+,用纯铜棒作阴极即可得精铜。
与“某课外小组对一些金属单质和化合物的性质进行研究。(1)下表为...”考查相似的试题有:
- 用含有Al2O3及少量Fe2O3和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):I.向铝土矿中加入...
- (12分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:请回答下列问题:⑴流程甲中...
- A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态...
- 将一定质量的Mg和Al的混合物投入2.0 mol/L,250 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入一定浓...
- 将Mg、Al、Zn三种金属混合物与足量的稀硫酸反应,得到3.36 L氢气(标准状况),则三种金属的物质的量之和可能为( )A.0.125 mol...
- (4分)已知X和Y是短周期元素中的不同族单质,W、V是化合物,他们有如下反应(式中各物质的系数,反应条件均略去): X+W Y+V试...
- 两份质量相同的铝片,分别与足量的盐酸和氢氧化钠溶液反应,在相同条件下分别产生的气体体积比是A.1:1B.2:3C.3:2D.1:6
- 称取两份铝粉,第一份加入足量的浓氢氧化钠溶液,第二份加入足量的稀盐酸,如要放出等体积的气体(在同温同压下),两份铝的...
- 下列反应中,反应后固体物质增重的是A.氢气通过灼热的CuO粉末B.二氧化碳通过Na2O2粉末C.铝与Fe2O3发生铝热反应D.将锌粒投...
- 铜及铜的化合物有多种应用.请回答下面相关问题:(1)下列两种方法均可以制备CuSO4①2Cu+O2 △ . 2CuO CuO+H2SO4=CuSO4+H2O ②C...