本试题 “氢化锂(LiH)、氘化锂(LiD)、氚化锂(LiT)在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中。下列有关说法中,正确的是[ ]A.LiH、LiD、LiT...” 主要考查您对氧化剂、还原剂
同位素
同素异形体
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化剂、还原剂
- 同位素
- 同素异形体
氧化剂:
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 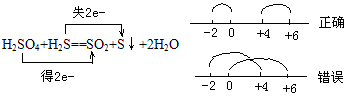
定义:
质子数相同而中子数不同的原子互称为同位素(即同一元素的不同核素互称为同位素)。元素符号表示不同,如 ;电子结构相同,原子核结构不同;物理性质不同,化学性质相同。
;电子结构相同,原子核结构不同;物理性质不同,化学性质相同。
同位素的应用:
(1)同位素在医学领域中的应用最为广泛,主要用于显像、诊断和治疗,还用于医疗用品消毒、药物作用机理研究和生理医学研究等。
(2)同位素辐射育种技术为农业提供了改进农产品质量、增加产量的新技术;利用同位素示踪技术,可检测并确定植物的最佳肥料吸入量和农药吸入量。
(3)14C纪年测定法与其他放射性同位素测定法已成为地质学、考古学、人类学、地球科学等领域广泛采用的一种准确的断代方法。
同素异形体:
同一元素组成的不同种单质。元素符号表示相同,分子式可不同,如石墨和金刚石、O2和O3;单质的组成或结构不同;物理性质不同,化学性质相似。
发现相似题
与“氢化锂(LiH)、氘化锂(LiD)、氚化锂(LiT)在一定条件下都可产生...”考查相似的试题有:
- 某炼金厂的废水因连降暴雨而溢出,导致河水严重污染,炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-...
- 下面对日本福岛核电站泄漏的放射性碘-131、铯-137说法正确的是[ ]A.碘-131的中子数为78B.碘-131质量数为53C.碘与铯互称同...
- 雷雨天,空气中有O3生成,下列说法正确的是( )A.O3和O2互为同位素B.O2比O3稳定C.等体积O3和O2含有相同质子数D.O3与O2的...
- 、H+、H2是[ ]A.氢的五种同位素B.五种氢元素C.氢的五种同素异形体D.氢元素的五种不同粒子
- 澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性...
- 有①16O、17O、18O②H2、D2、T2③石墨、金刚石 ④1H、2H、3H四组微粒或物质.互为同位素的是(填序号)______;互为同素异形体的...
- 下列属于同素异形体的一组物质是( )A.12C和14CB.氯气和液氯C.CH3CH2OH和CH3-O-CH3D.N2和N4
- 下列各组物质中互为同素异形体的是[ ]A.126C和146CB.水和重水(D2O)C.氨水和液氨D.红磷和白磷
- 澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,他外形类似海绵,比重极小,并具有磁性...
- (1)下面列出了几组物质,请将物质的合适组号填写在空格上.互为同位素的是______;互为同分异构体的是______;互为同素异形...