本试题 “某温度时,在1.0 L密闭容器内加入2.0 mol SO2和1.2 mol O2,发生反应: 2SO2(g)+O2(g)2SO3(g) 请回答:(1)反应进行2 min后,测得SO2为1.4 mol,则2 min内v(SO...” 主要考查您对吸热反应、放热反应
化学平衡常数
化学反应速率的计算
化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 吸热反应、放热反应
- 化学平衡常数
- 化学反应速率的计算
- 化学平衡的有关计算
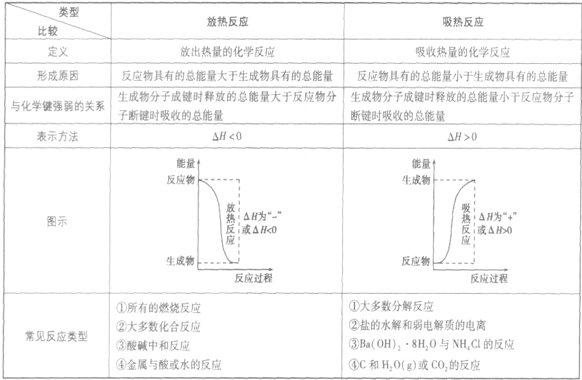
吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

定义:
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)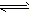 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: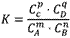
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)
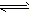 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: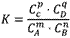
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
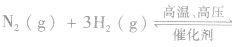


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
化学反应速率的求算:
首先要熟练掌握化学反应速率的含义,明确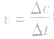 中各个量的含义和单位,如:以具体某一种物质 B表示的化学反应速率为
中各个量的含义和单位,如:以具体某一种物质 B表示的化学反应速率为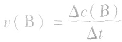 。△c的单位一般用mol/L表示,而△t的单位一般用s(秒)、min (分钟)、h(小时)等表示,所以v的单位可以是
。△c的单位一般用mol/L表示,而△t的单位一般用s(秒)、min (分钟)、h(小时)等表示,所以v的单位可以是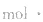

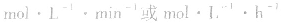 等。对于反应
等。对于反应 ,有
,有 ,利用这一关系,可以很方便地求算出不同物质表示的v的数值:
,利用这一关系,可以很方便地求算出不同物质表示的v的数值:
化学反应速率图像及其应用:
1.物质的量(或浓度)一时间图像及应用此类图像能说明反应体系各组分(或某一组分)在反应过程中的浓度变化情况。如A(g) +B(g)
 3C(g)的反应情况如图所示,
3C(g)的反应情况如图所示,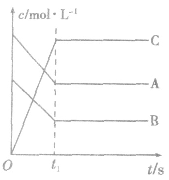
要注意此类图像各曲线的折点(达平衡)时刻相同,各物质浓度变化符合化学方程式中的计量数关系。例如:某温度时,在恒容(VL)容器中,X、Y、z三种物质的物质的量随时间的变化曲线如下图所示。
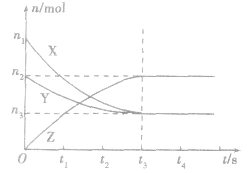
根据图像可进行如下计算:
(1)计算某物质在O一t3刻的平均反应速率、转化率,如
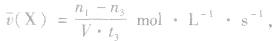 Y的转化率为
Y的转化率为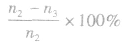 .
.(2)确定化学方程式中各物质的化学计量数之比如X、Y、z三种物质的化学计量数之比为: (n1一n3):(n2一n3):n2。
2.全程速率一时间图像如Zn与足量盐酸的反应,反应速率随时间的变化出现的情况,如图所示,

解释原因:AB段(v增大),因反应为放热反应,随反应的进行,温度升高,导致反应速率增大;BC段(v减小),则主要因为随反应的进行,溶液中 c(H+)减小,导致反应速率减小。故分析时要抓住各阶段的主要矛盾,认真分析。
3.速率一温度(压强)图像这类图像有两种情况:一是不隐含时间变化的速率一温度(压强)图,二是隐含时间变化的速率一温度 (压强)图。以
 ,△H< 0为例,V一T(P)图像如下:
,△H< 0为例,V一T(P)图像如下: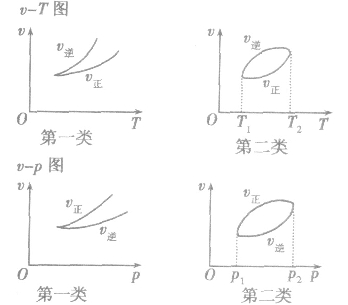
化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
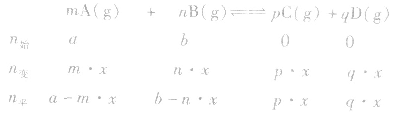
则有:

(2)对于反应物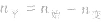 ,对于生成物
,对于生成物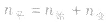
(3)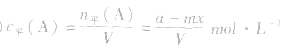
(4)A的转化率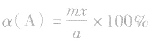
(5)平衡时A的体积(物质的量)分数
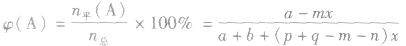
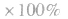
(6)
(7)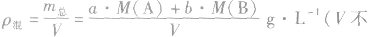
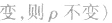
(8)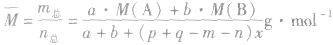
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
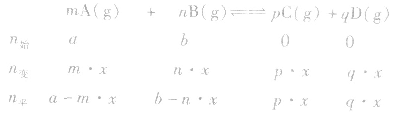
则有:

(2)对于反应物
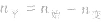 ,对于生成物
,对于生成物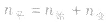
(3)
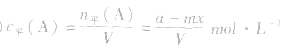
(4)A的转化率
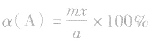
(5)平衡时A的体积(物质的量)分数
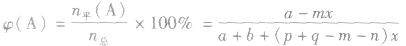
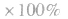
(6)

(7)
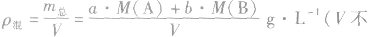
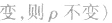
(8)
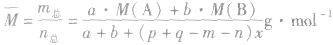
发现相似题
与“某温度时,在1.0 L密闭容器内加入2.0 mol SO2和1.2 mol O2,...”考查相似的试题有:
- 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。实验测得起始、平...
- PCl5(气)PCl3(气) +Cl2(气) △H>0 当反应达到平衡时,下列措施:①降温②恒容通入惰性气体③增加Cl2的浓度④加压⑤加催化剂⑥恒压通...
- (1)对可逆反应aA(g)+bB(g)cC(s)+dD(g)达到平衡时,其反应的K值与温度有关。请写出该反应的平衡常数表达式_____________现...
- 下列事实不能用勒夏特列原理解释的是A.开启啤酒瓶后,瓶中马上泛起大量泡沫B.钢铁在潮湿的空气中容易生锈C.工业合成氨时常...
- 实验表明,相同温度下,液态纯硫酸的导电性强于纯水。已知液态电解质都能像水那样自身电离而建立电离平衡(如H2O+H2OH3O++...
- 对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g)。下列反应速率关系中,正确的是[ ]A.v(W)=3v(Z)B.2v(X)=3v(Z)C.2v(X)=v(Y)D.3v(W)=...
- 将4mol SO2(g)与2molO2(g)放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+ O2(g)2SO3(g) 测得平衡时混合物总的物质...
- 在一定温度下,向容积固定不变的密闭容器中充入a mol PCl5,发生如下反应:PCl5(g) PCl3(g)+Cl2(g);达平衡后再向容器...
- 将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应 NO2(g)+CO(g)CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为C...
- 密闭容器中,反应xA(g)+yB(g)zC(g)达平衡时,A的浓度为0.5mol·L-1,若保持温度不变,将容器的容积扩大到原来的2倍,达...