本试题 “【三选一化学与技术】海水的综合利用,对于人类的生产生活有重要的意义。(1)海水淡化沿海缺水地区获取淡水的方法之一,列举出海水淡化的两种方法__________...” 主要考查您对海水资源的综合利用
工业生产纯碱
氯碱工业
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 海水资源的综合利用
- 工业生产纯碱
- 氯碱工业
海水资源的综合利用:
浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
海水制盐:
(1)海水制盐的方法:从海水中得到食盐的方法有蒸发法(盐田法)、电渗析法等。目前,以蒸发法(盐田法)为主。
(2)海水晒盐的基本原理:水分不断蒸发,氯化钠等盐结晶析出。
(3)海水晒盐的流程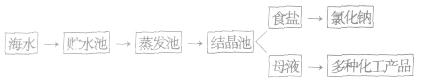
氯碱工业:
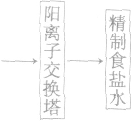
(1)食盐水的精制
(2)电极反应
阴极: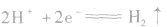
阳极:
总反应: :
:
(3)主要设备
离子交换膜电解槽一一阳极用金属钛(表面涂有钛、钉氧化物层)制成,阴极用碳钢(覆有镍镀层)制成。阳离子膜具有选择透过性,只允许Na+透过,而Cl-、 OH一和气体不能透过。 
(4)产品及用途
烧碱:可用于造纸、玻璃、肥皂等工业
氯气:可用于制农药、有机合成、氯化物的合成
氢气:可用于金属冶炼、有机合成、盐酸的制取
海水提溴:
(1)氯化
氯化氧化溴离子,在pH=3.5的酸性条件下效果最好,所以在氯化之前要将海水酸化。
(2)吹出
当海水中的Br一被氧化成Br2以后,用空气将其吹出。另外,也可以用水蒸气,使溴和水蒸气一起蒸出。
(3)吸收
目前比较多的是用二氧化硫作还原剂,使溴单质转化为HBr,再用氯气将其氧化得到溴产品。化学方程式如下: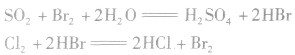
海水提镁:
(1)工艺流程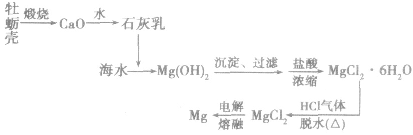
(2)主要化学反应
①制备石灰乳: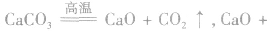
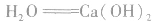
②沉淀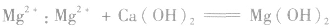
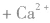
③制备
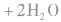
从海水中提取重水:
提取重水的方法:蒸馏法、电解法、化学交换法、吸附法等。常用方法:化学交换法(硫化氢一水双温交换法)
铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水对一个国家来说具有战略意义,化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能也是越来越受到重视的新型能源。
工业生产纯碱:
纯碱(学名碳酸钠)实际上是盐,由于它在水中发生水解作用而使溶液呈碱性。纯碱易溶于水,呈强碱性,能提供
Na+离子。这些性质使它们被广泛地用于制玻璃、肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。
碳酸钠在自然界中存在相当广泛。一些生长在盐碱地和海岸附近的植物中含有碳酸钠,可以从植物的灰烬中提取;当冬季来临时,碱湖中所含的碳酸钠结晶析出,经过简单的加工就可以使用。
世界上最早是通过路布兰法实现了碳酸钠的工业生产。其生产原理是:
用硫酸将食盐转变成硫酸钠
NaCl+H2SO4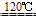 NaHSO4+HCl↑NaCl+NaHSO4
NaHSO4+HCl↑NaCl+NaHSO4 Na2SO4+HCl↑
Na2SO4+HCl↑
将硫酸钠与木炭、石灰石一起加热,反应生成碳酸钠和硫化钙
Na2SO4+2C Na2S+2CO2↑ Na2S+CaCO3
Na2S+2CO2↑ Na2S+CaCO3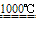 Na2CO3+CaS
Na2CO3+CaS
存在原料利用不充分、成本较高、设备腐蚀严重等
氨碱法生产硫酸:
氨碱法是由比利时人索尔维发明的,所以,氨碱法也称为索尔维制碱法。氨碱法的原料也是氯化钠和碳酸钙,不同的是它还使用了炼焦的副产品氨。
原料:CaCO3、NaCl、NH3
1.生成碳酸氢钠和氯气铵
将CO2通入含NH3的饱和NaCl溶液中
NH3+CO2+H2O==NH4HCO3 NaCl+NH4HCO3==NaHCO3↓+NH4Cl
2.抽取碳酸钠2NaHCO3 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑
氨碱法生产原理:
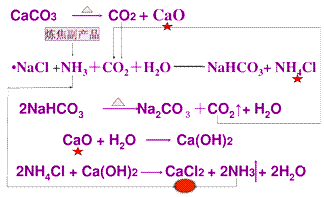
氨碱法的优点:原料便宜易得,氨和部分二氧化碳可循环利用,产品纯度高,步骤简单。氨碱法的缺点:副产物氯化钙的处理问题,氯化钠的利用率低。
联合制碱法:
我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称联合制碱法或侯德榜制碱法,副产品的一种用途为化肥或电解液或焊药等。
(2)沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
(3)写出上述流程中X物质的分子式CO2。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了I 的循环。从沉淀池中取出沉淀的操作是过滤
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:
①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺;这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
纯碱(学名碳酸钠)实际上是盐,由于它在水中发生水解作用而使溶液呈碱性。纯碱易溶于水,呈强碱性,能提供
Na+离子。这些性质使它们被广泛地用于制玻璃、肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。
碳酸钠在自然界中存在相当广泛。一些生长在盐碱地和海岸附近的植物中含有碳酸钠,可以从植物的灰烬中提取;当冬季来临时,碱湖中所含的碳酸钠结晶析出,经过简单的加工就可以使用。
世界上最早是通过路布兰法实现了碳酸钠的工业生产。其生产原理是:
用硫酸将食盐转变成硫酸钠
NaCl+H2SO4
 NaHSO4+HCl↑NaCl+NaHSO4
NaHSO4+HCl↑NaCl+NaHSO4 Na2SO4+HCl↑
Na2SO4+HCl↑ 将硫酸钠与木炭、石灰石一起加热,反应生成碳酸钠和硫化钙
Na2SO4+2C
 Na2S+2CO2↑ Na2S+CaCO3
Na2S+2CO2↑ Na2S+CaCO3 Na2CO3+CaS
Na2CO3+CaS 存在原料利用不充分、成本较高、设备腐蚀严重等
氨碱法生产硫酸:
氨碱法是由比利时人索尔维发明的,所以,氨碱法也称为索尔维制碱法。氨碱法的原料也是氯化钠和碳酸钙,不同的是它还使用了炼焦的副产品氨。
原料:CaCO3、NaCl、NH3
1.生成碳酸氢钠和氯气铵
将CO2通入含NH3的饱和NaCl溶液中
NH3+CO2+H2O==NH4HCO3 NaCl+NH4HCO3==NaHCO3↓+NH4Cl
2.抽取碳酸钠2NaHCO3
 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑ 氨碱法生产原理:

氨碱法的优点:原料便宜易得,氨和部分二氧化碳可循环利用,产品纯度高,步骤简单。氨碱法的缺点:副产物氯化钙的处理问题,氯化钠的利用率低。
联合制碱法:
我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称联合制碱法或侯德榜制碱法,副产品的一种用途为化肥或电解液或焊药等。
(2)沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
(3)写出上述流程中X物质的分子式CO2。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了I 的循环。从沉淀池中取出沉淀的操作是过滤
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:
①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺;这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
氯碱工业:
1.离子交换膜法电解制碱的主要生产流程可以简单表示如下图所示:

电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙,精制食盐水时经常进行以下措施
(1)过滤海水
(2)加入过量氢氧化钠,去除钙、镁离子,过滤 Ca2++2OH-=Ca(OH)2(微溶) Mg2++2OH-=Mg(OH)2↓
(3)加入过量氯化钡,去除硫酸根离子,过滤 Ba2++SO42-=BaSO4↓
(4)加入过量碳酸钠,去除钙离子、过量钡离子,过滤 Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓
(5)加入适量盐酸,去除过量碳酸根离子 2H++CO32-=CO2↑+H2O
(6)加热驱除二氧化碳
(7)送入离子交换塔,进一步去除钙、镁离子
(8)电解 2NaCl+2H2O H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。
H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。
2.以氯碱工业为基础的化工生产
NaOH、Cl2和H2都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于各工业。所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域。
由电解槽流出的阴极液中含有30%的NaOH,称为液碱,液碱经蒸发、结晶可以得到固碱。阴极区的另一产物湿氢气经冷却、洗涤、压缩后被送往氢气贮柜。阳极区产物湿氯气经冷却、干燥、净化、压缩后可得到液氯。
2NaOH+Cl2=NaCl+NaClO+H2O H2O+Cl2=HCl+HClO H2+Cl2=2HCl 2NaOH+CO2=Na2CO3(苏打)+H2O NaOH+CO2=NaHCO3(小苏打)
随着人们环境保护意识的增强,对以氯碱工业为基础的化工生产过程中所造成的污染及其产品对环境造成的影响越来越重视。
1.离子交换膜法电解制碱的主要生产流程可以简单表示如下图所示:

电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙,精制食盐水时经常进行以下措施
(1)过滤海水
(2)加入过量氢氧化钠,去除钙、镁离子,过滤 Ca2++2OH-=Ca(OH)2(微溶) Mg2++2OH-=Mg(OH)2↓
(3)加入过量氯化钡,去除硫酸根离子,过滤 Ba2++SO42-=BaSO4↓
(4)加入过量碳酸钠,去除钙离子、过量钡离子,过滤 Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓
(5)加入适量盐酸,去除过量碳酸根离子 2H++CO32-=CO2↑+H2O
(6)加热驱除二氧化碳
(7)送入离子交换塔,进一步去除钙、镁离子
(8)电解 2NaCl+2H2O
 H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。
H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。 2.以氯碱工业为基础的化工生产
NaOH、Cl2和H2都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于各工业。所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域。
由电解槽流出的阴极液中含有30%的NaOH,称为液碱,液碱经蒸发、结晶可以得到固碱。阴极区的另一产物湿氢气经冷却、洗涤、压缩后被送往氢气贮柜。阳极区产物湿氯气经冷却、干燥、净化、压缩后可得到液氯。
2NaOH+Cl2=NaCl+NaClO+H2O H2O+Cl2=HCl+HClO H2+Cl2=2HCl 2NaOH+CO2=Na2CO3(苏打)+H2O NaOH+CO2=NaHCO3(小苏打)
随着人们环境保护意识的增强,对以氯碱工业为基础的化工生产过程中所造成的污染及其产品对环境造成的影响越来越重视。
发现相似题
与“【三选一化学与技术】海水的综合利用,对于人类的生产生活有...”考查相似的试题有:
- 以下物质的工业制备所用主要原料(括号内物质)不符合事实的是A.碘(海带)B.氢氧化钠(食盐水)C.乙烯(乙醇)D.铁(铁矿石)
- (10分)第63届联合国大会通过决议,将2011年定为“国际化学年”,其主题是“化学——我们的生活,我们的未来”,以纪念化学学科所...
- 下列描述不正确的是A.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的...
- 以海水中常见物质A为原料可以发展很多工业,图中包含几种基本工业生产,下列判断不正确的是( )A.若C和D、C和G反应都可以制...
- 下列关于化工生产原理的叙述中,均符合目前工业生产实际的是A.氯碱工业中,电解槽的阳极区产生NaOHB.氯气和氢气混合在光照...
- 下列过程中,涉及化学变化的是[ ]A.氯气通入水中制氯水B.四氯化碳萃取碘水中的碘C.活性炭使红墨水褪色D.蒸馏法将海水淡化...
- 根据侯德榜制减法原理并参考下表的数据,实验室制备纯碱Na2CO2的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温...
- Ⅰ.下列叙述正确的是______.A.“接触法”制H2SO4时,催化氧化阶段的反应原理为2SO2(g)+O2(g)催化剂△2SO3(g)△H<0B.海...
- 氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水同时得到两种气体(一种是气体中密度最小的气体,一种是黄绿色气体...
- MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸...