本试题 “(1)在实验室里可以用浓盐酸跟二氧化锰起反应制取氯气,反应的化学方程式为:______________________________________________________。(2)往过氧化氢溶...” 主要考查您对极性键、非极性键
共价化合物
可逆反应与不可逆反应
原电池原理
氯气的制取
实验中的试剂使用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 极性键、非极性键
- 共价化合物
- 可逆反应与不可逆反应
- 原电池原理
- 氯气的制取
- 实验中的试剂使用
极性键和非极性键:
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
分子空间构型、键的极性与分子的极性:

化学键与物质类别:
1.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。例如: 等。
等。
2.只含非极性共价键的物质:同种非金属元素构成的单质。例如: 、金刚石等。
、金刚石等。
3.既有极性键又有非极性键的物质。例如: 等。
等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。例如: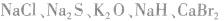 等。
等。
5.既有离子键又有非极性键的物质。例如: 等。
等。
6.既有离子键又有极性键的物质。例如: 等。
等。
7.由离子键、共价键、配位键构成的物质。例如: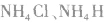 等。
等。
8.只含有共价键而无范德华力的物质。例如:金刚石、晶体硅、 等原子晶体。
等原子晶体。
9.由强极性键构成但又不是强电解质的物质。例如:HF。
10.没有化学键的物质。例如:稀有气体(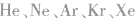 等)。
等)。
定义:
直接相邻原子间均以共价键相结合的化合物。共价化合物中只含共价键。
离子化合物和共价化合物的比较:

直接相邻原子间均以共价键相结合的化合物。共价化合物中只含共价键。
离子化合物和共价化合物的比较:

可逆反应与不可逆反应:
(1)可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
注:①在可逆反应中,由反应物到生成物的反应叫正反应;由生成物到反应物的反应叫逆反应。
②可逆反应必须是“同一条件”。
(2)不可逆反应:在不同条件下能向两个方向进行的反应为不可逆反应。如:点燃情况下,氢气和氧气能生成水;在通电条件下,水电解能生成氢气和氧气。
可逆反应的特点:
①可逆反应必须是同一条件下既能向正反应方向又能向逆反应方向进行的反应,对于在不同条件下向正、逆反直方向进行的反应则不能认为是可逆反应。
②可逆反应是不能进行到底的,不能实现完全转化
(1)可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
注:①在可逆反应中,由反应物到生成物的反应叫正反应;由生成物到反应物的反应叫逆反应。
②可逆反应必须是“同一条件”。
(2)不可逆反应:在不同条件下能向两个方向进行的反应为不可逆反应。如:点燃情况下,氢气和氧气能生成水;在通电条件下,水电解能生成氢气和氧气。
可逆反应的特点:
①可逆反应必须是同一条件下既能向正反应方向又能向逆反应方向进行的反应,对于在不同条件下向正、逆反直方向进行的反应则不能认为是可逆反应。
②可逆反应是不能进行到底的,不能实现完全转化
原电池:
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例
(1)装置图:
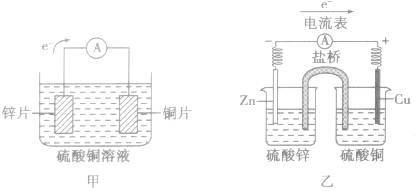
(2)原理图:
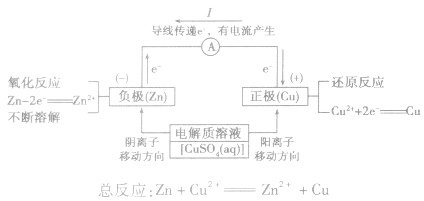
3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
氯气的实验室制法:
(1)实验室用浓盐酸和二氧化锰反应制取氯气。 
(2)装置图: 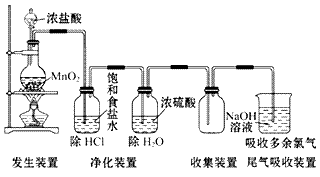
(3) 步骤: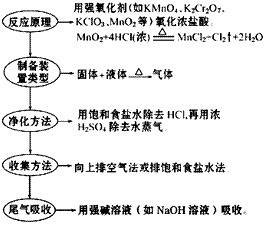

氯气的工业制法:
(1)电解饱和食盐水(氯碱工业),化学方程式为: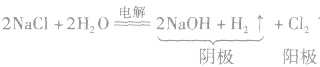
(2)电解熔融的氯化钠(可制得金属蚋),化学方程式为:
(3)电解熔融的氯化镁(可制得金属镁),化学方程式为:
实验中试剂的使用:
用稀硝酸与铁反应制取氢气(硝酸具有氧化性,铁与稀硝酸反应生成一氧化氮,不能制取氢气)
用酒精萃取碘水中的碘(碘能溶于酒精,不能用酒精萃取碘)
用食醋鉴别小苏打和食盐(乙酸和小苏打反应,有气泡生成,与食盐不反应,可以鉴别小苏打和食盐)
用饱和碳酸钠溶液除去CO2中的HCl(二氧化碳也能和碳酸钠反应,试剂选择错误,应用饱和碳酸氢钠溶液)
用稀硝酸与铁反应制取氢气(硝酸具有氧化性,铁与稀硝酸反应生成一氧化氮,不能制取氢气)
用酒精萃取碘水中的碘(碘能溶于酒精,不能用酒精萃取碘)
用食醋鉴别小苏打和食盐(乙酸和小苏打反应,有气泡生成,与食盐不反应,可以鉴别小苏打和食盐)
用饱和碳酸钠溶液除去CO2中的HCl(二氧化碳也能和碳酸钠反应,试剂选择错误,应用饱和碳酸氢钠溶液)
发现相似题
与“(1)在实验室里可以用浓盐酸跟二氧化锰起反应制取氯气,反应...”考查相似的试题有:
- 根据下列10种物质的化学式与序号,填写下列空白。①O2、②H2、③NH4NO3、④K2O2、⑤Ba(OH)2、 ⑥CH4、⑦CO2、⑧NaF、⑨NH3、⑩I2。(1)由...
- 下列说法正确的是[ ]A.非金属氧化物一定是非电解质B.共价化合物一定不是强电解质C.离子化合物一定不含共价键D.置换反应一...
- 固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体。这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离...
- (5分)下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。(1)A中反应的离子方程式是_____________________________...
- 某研究小组发明了一种葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生反应,总反应方程式为C6H12O6+6O...
- 将铜片和锌片用导线连接后插入番茄里,如右图所示,电流计指针发生偏转,铜片是A.正极B.电子流出的一极C.发生氧化反应的一...
- 在实验室里,可用同一套仪器制取的气体是A.NH3和Cl2B.NH3和O2C.CO2和O2D.Cl2和CO2。
- 某研究小组探究SO2和Fe(NO3)3溶液的反应。已知: 1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答:(1)装置A中反应的化学方程式是...
- 实验室现有一瓶含少量氯化钙的氯化钾,通过下面的实验制取纯净的氯化钾,根据实验步骤填写下列空白。(1)加入的A是 ,检验A...
- 关于下列各实验装置的叙述中,正确的是 ( )A.装置①常用于分离互不相溶的液体B.装置②可用于吸收NH3C.装置③可用于制备乙酸...