本试题 “随着环保意识的增强,清洁能源越来越受人们关注。(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802.3 kJ/molH2O(l)=H2O(g) △H=+44 kJ/mol...” 主要考查您对基元反应、非基元反应
化学平衡常数
化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 基元反应、非基元反应
- 化学平衡常数
- 化学反应热的计算
基元反应:
分子经一次碰撞后,在一次化学行为中就能完成反应,这种反应成为基元反应。
非基元反应:
由二个或二个以上的基元反应构成的化学反应称复杂反应或非基元反应。
分子经一次碰撞后,在一次化学行为中就能完成反应,这种反应成为基元反应。
非基元反应:
由二个或二个以上的基元反应构成的化学反应称复杂反应或非基元反应。
定义:
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)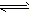 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: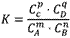
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
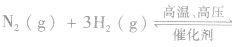


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)
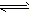 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: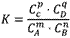
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
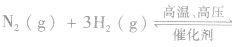


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
应用盖斯定律进行计算的方法:
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
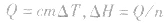
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
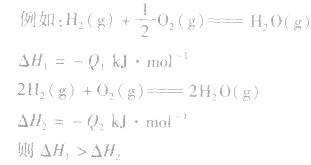
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即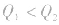 .
.
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
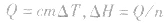
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
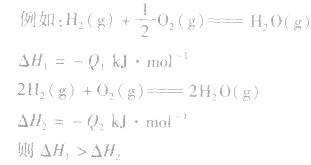
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
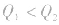 .
. 发现相似题
与“随着环保意识的增强,清洁能源越来越受人们关注。(1)甲烷是一...”考查相似的试题有:
- 将2 mol A和1 mol B充入一个密闭容器中,在一定条件下发生:2A(g)+B(g)xC(g)达到平衡,测得C的物质的量分数为c%;若开始...
- 对平衡体系CO2(g)CO2(aq) ΔH=-19.75kJ·mol-,为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应采取的方法是A.升...
- 在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是A.该反应的化学方程式为5A+4B4...
- 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )。A.化学方程式为:2MNB...
- 反应P(g)+Q(g)M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是A.减小容器体积,平衡不移动B.加入催化剂,M的产率增大C.增...
- 在恒容密闭容器中进行反应:,反应经5分钟达到平衡,测得此时A的浓度减小了a mol/L,而C的浓度增加了2/3 a mol/L,又知平均反...
- 科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的Ti...
- 将NO2装入带活塞的密闭容器中,当反应2NO2(g)N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是()A.升高温度,...
- 在557℃时,密闭容器中进行下列反应CO+H2OCO2+H2。若(1)(2),达到平衡时,测得CO2的浓度为1.2mol/L。求CO及H2O的转化率。
- 在一定温度下,向一个容积不变的容器中,加入2mol N2和8mol H2及固体催化剂,使之反应,平衡时容器内气体压强为起始时的80%,...