本试题 “下列说法正确的是( )A.Mg的第一电离能低于AlB.ns、np、nd、nf能级的能量依次升高C.ns、np、nd、nf能级拥有的轨道数分别为2、6、10、14D.电子云图通常用...” 主要考查您对能层和能级
能量最低原理
电负性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 能层和能级
- 能量最低原理
- 电负性
能层和能级:
(1)能层:在多电子的原子核外电子的能力是不同的,按电子的能力差异,可将核外电子分成不同的能层。
能层表示两方面意义:
①表示电子到原子核的平均距离不同
②表示电子的能力不同
能层分为:K L M N O P…
所包含电子数:2 8 18 32 …
(2)能级:在多电子原子中,同一能层的电子能量也不同,还可以把它们分成能级。
能级表示两方面意义:
①表示电子云形状不同,s电子云是以原子核为中心的球形,P电子云是表示以原子核为中心的无柄哑铃型(纺锤形),d和f电子云形状更复杂
②表示能量不同,s p d f电子能量依次增高。
能层、能级、原子轨道及所含电子数之间的关系:
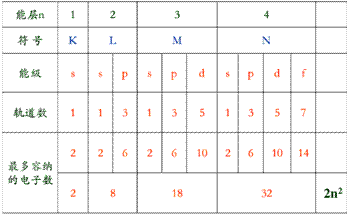
第n能层,有n个能级,有n2个原子轨道,最多容纳2n2个电子
(1)能层:在多电子的原子核外电子的能力是不同的,按电子的能力差异,可将核外电子分成不同的能层。
能层表示两方面意义:
①表示电子到原子核的平均距离不同
②表示电子的能力不同
能层分为:K L M N O P…
所包含电子数:2 8 18 32 …
(2)能级:在多电子原子中,同一能层的电子能量也不同,还可以把它们分成能级。
能级表示两方面意义:
①表示电子云形状不同,s电子云是以原子核为中心的球形,P电子云是表示以原子核为中心的无柄哑铃型(纺锤形),d和f电子云形状更复杂
②表示能量不同,s p d f电子能量依次增高。
能层、能级、原子轨道及所含电子数之间的关系:

第n能层,有n个能级,有n2个原子轨道,最多容纳2n2个电子
能量最低原理:
原子核外的电子应优先排布在能量最低的能级,然后由里到外,一次排布在能量逐渐升高的能级里。
能级能量高低的顺序为:1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
原子核外的电子应优先排布在能量最低的能级,然后由里到外,一次排布在能量逐渐升高的能级里。
能级能量高低的顺序为:1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
电负性:
(1)键合电子、电负性的定义
元素相互化合时,原子中用于形成化学键的电子称为键合电子。电负性用来描述不同元素的原子对键合电子吸引力的大小。
(2)电负性的意义:电负性越大的原子,对键合电子的吸引力越大。
(3)电负性大小的标准:以氟的电负性为4.0作为相对标准。
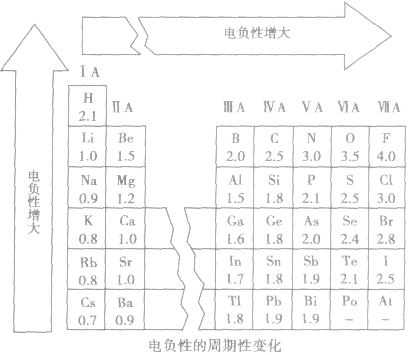
(4)电负性的变化规律
①随原子序数的递增,元素的电负性呈周期性变化。
②同周期,从左到右,元素的电负性逐渐变大。
③同主族,从上到下,元素的电负性逐渐变小。
电负性的应用:
①判断元素的金属性和非金属性的强弱
金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②判断元素化合价的正负
利用电负性可以判断化合物中元素化合价的正负:电负性大的元素易呈现负价,电负性小的元素易呈现正价。
③判断化学键的类型
一般认为,如果成键原子所属元素的电负性差值大于 1.7,它们之间通常形成离子键;如果成键原子所属元素的电负性差值小于1.7,它们之间通常形成共价键。
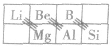
④解释“对角线规则”
在元素周期表中,某些主族元素与其右下方的主族元素(如右图所示)的有些性质是相似的,被称为“对角线规则”。例如:硼和硅的含氧酸盐都能形成玻璃且互熔,含氧酸都是弱酸等。
发现相似题
与“下列说法正确的是( )A.Mg的第一电离能低于AlB.ns、np、nd...”考查相似的试题有:
- 下列关于能层与能级的说法中正确的是[ ]A.原子核外电子的每一个能层最多可容纳的电子数为2n2B.任一能层的能级总是从s能级开...
- A原子的结构示意图为。则X、Y及该原子3p能级上的电子数分别为[ ]A.18、6、4B.20、8、6C.18、8、6D.15~20、3~8、1~6
- 下列有关认识正确的是[ ]A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7B.各能层的能级都是从s能级开始至f能级结...
- 以下能级符号不正确的是( )A.3sB.3pC.3dD.3f
- 经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键...
- 决定物质性质的重要因素是物质结构.请回答下列问题.(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:电...
- (二选一)【物质结构与性质】能源、材料和信息是现代社会的三大“支柱”。(1)目前,利用金属或合金储氢的研究已取得很大进展...
- X和Y是原子序数大于4的短周期元素,Xm+和Yn-两种离子的核外电子排布相同,下列说法中正确的是[ ]A.X的原子半径比Y小B.X和Y...
- 已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )A.X与Y形成化合物时,X可以显负价,Y显正价B.第一电离能可能Y小...
- 有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排...