本试题 “下列有关认识正确的是[ ]A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7B.各能层的能级都是从s能级开始至f能级结束C.各能层含有的能级数为n-1D...” 主要考查您对能层和能级
电子云和原子轨道
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 能层和能级
- 电子云和原子轨道
能层和能级:
(1)能层:在多电子的原子核外电子的能力是不同的,按电子的能力差异,可将核外电子分成不同的能层。
能层表示两方面意义:
①表示电子到原子核的平均距离不同
②表示电子的能力不同
能层分为:K L M N O P…
所包含电子数:2 8 18 32 …
(2)能级:在多电子原子中,同一能层的电子能量也不同,还可以把它们分成能级。
能级表示两方面意义:
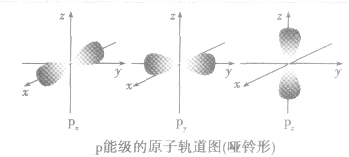
①表示电子云形状不同,s电子云是以原子核为中心的球形,P电子云是表示以原子核为中心的无柄哑铃型(纺锤形),d和f电子云形状更复杂
②表示能量不同,s p d f电子能量依次增高。
能层、能级、原子轨道及所含电子数之间的关系:
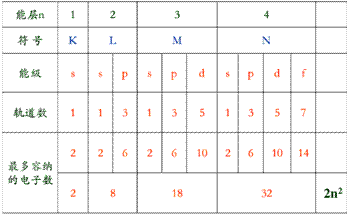
第n能层,有n个能级,有n2个原子轨道,最多容纳2n2个电子
(1)能层:在多电子的原子核外电子的能力是不同的,按电子的能力差异,可将核外电子分成不同的能层。
能层表示两方面意义:
①表示电子到原子核的平均距离不同
②表示电子的能力不同
能层分为:K L M N O P…
所包含电子数:2 8 18 32 …
(2)能级:在多电子原子中,同一能层的电子能量也不同,还可以把它们分成能级。
能级表示两方面意义:
①表示电子云形状不同,s电子云是以原子核为中心的球形,P电子云是表示以原子核为中心的无柄哑铃型(纺锤形),d和f电子云形状更复杂
②表示能量不同,s p d f电子能量依次增高。
能层、能级、原子轨道及所含电子数之间的关系:

第n能层,有n个能级,有n2个原子轨道,最多容纳2n2个电子
核外电子运动状态:
核外电子的运动特征核外电子的质量很小,运动空间小,但运动速度却很大,接近光速。
由于电子的绕核运转是高速的、无规律的,因此我们无法预测电子在某一时刻的位置,只能预测电子在某一区域内出现几率的大小。
现代量子力学指出,核外电子的运动不能像经典力学中确定宏观物体的运动状态那样,同时用位置和速度的物理量来准确描述它的运动状态,而只能确定它在原子核外各处出现的概率。
电子云:
由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云。换句话说,电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。
电子云密度大的地方,表明电子在核外空间单位体积内出现的机会多;电子云密度小的地方,表明电子在核外空间单位体积内出现的机会少。
原子轨道:
(1)定义:量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
(2)原子轨道的形状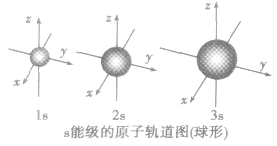
发现相似题
与“下列有关认识正确的是[ ]A.各能级的原子轨道数按s、p、d、f...”考查相似的试题有:
- 下列说法正确的是( )A.Mg的第一电离能低于AlB.ns、np、nd、nf能级的能量依次升高C.ns、np、nd、nf能级拥有的轨道数分别...
- 下列能级中轨道数为3的是[ ]A.s能级B.p能级C.d能级D.f能级
- 下列说法中正确的是[ ]A.处于最低能量的原子叫做基态原子B.3p2表示3p能级有两个轨道C.同一原子中,1s、2s、3s电子的能量逐...
- 第三周期元素的原子,其最外层p能级上仅有一个未成对电子,它最高价氧化物对应的水化物的酸根离子是[ ]A.RO3-B.RO5-C.RO42...
- (1)某元素原子序数为24,试问:它有_______个能层?________个能级?占有___________个原子轨道?(2)用价层电子对互斥模...
- 下列说法正确的是( )A.因为p轨道是“8”字形的,所以p电子走“8”字形B.第三电子层,有3s、3p、3d三个轨道C.原子轨道与电子...
- 下列有关电子云和原子轨道的说法正确的是( ) A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云 B.s能级的原子轨...
- 下列有关认识正确的是[ ]A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7B.各能层的能级都是从s能级开始至f能级结...
- 下面关于多电子原子核外电子的运动规律的叙述正确的是( )A.核外电子是分层运动的B.所有电子在同一区域里运动C.能量高的...
- 核能已成为当今世界的主要能源。(1)核原料UO2可通过三碳酸铀酰铵(NH4)4[UO2(CO3)3]直接煅烧还原制得。UO2晶体属CaF2型面心立...