本试题 “我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行...” 主要考查您对工业生产纯碱
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 工业生产纯碱
工业生产纯碱:
纯碱(学名碳酸钠)实际上是盐,由于它在水中发生水解作用而使溶液呈碱性。纯碱易溶于水,呈强碱性,能提供
Na+离子。这些性质使它们被广泛地用于制玻璃、肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。
碳酸钠在自然界中存在相当广泛。一些生长在盐碱地和海岸附近的植物中含有碳酸钠,可以从植物的灰烬中提取;当冬季来临时,碱湖中所含的碳酸钠结晶析出,经过简单的加工就可以使用。
世界上最早是通过路布兰法实现了碳酸钠的工业生产。其生产原理是:
用硫酸将食盐转变成硫酸钠
NaCl+H2SO4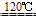 NaHSO4+HCl↑NaCl+NaHSO4
NaHSO4+HCl↑NaCl+NaHSO4 Na2SO4+HCl↑
Na2SO4+HCl↑
将硫酸钠与木炭、石灰石一起加热,反应生成碳酸钠和硫化钙
Na2SO4+2C Na2S+2CO2↑ Na2S+CaCO3
Na2S+2CO2↑ Na2S+CaCO3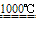 Na2CO3+CaS
Na2CO3+CaS
存在原料利用不充分、成本较高、设备腐蚀严重等
氨碱法生产硫酸:
氨碱法是由比利时人索尔维发明的,所以,氨碱法也称为索尔维制碱法。氨碱法的原料也是氯化钠和碳酸钙,不同的是它还使用了炼焦的副产品氨。
原料:CaCO3、NaCl、NH3
1.生成碳酸氢钠和氯气铵
将CO2通入含NH3的饱和NaCl溶液中
NH3+CO2+H2O==NH4HCO3 NaCl+NH4HCO3==NaHCO3↓+NH4Cl
2.抽取碳酸钠2NaHCO3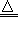 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑
氨碱法生产原理:
氨碱法的优点:原料便宜易得,氨和部分二氧化碳可循环利用,产品纯度高,步骤简单。氨碱法的缺点:副产物氯化钙的处理问题,氯化钠的利用率低。
联合制碱法:
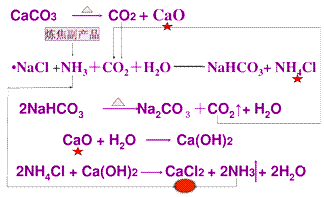
我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称联合制碱法或侯德榜制碱法,副产品的一种用途为化肥或电解液或焊药等。
(2)沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
(3)写出上述流程中X物质的分子式CO2。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了I 的循环。从沉淀池中取出沉淀的操作是过滤
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:
①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺;这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
纯碱(学名碳酸钠)实际上是盐,由于它在水中发生水解作用而使溶液呈碱性。纯碱易溶于水,呈强碱性,能提供
Na+离子。这些性质使它们被广泛地用于制玻璃、肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。
碳酸钠在自然界中存在相当广泛。一些生长在盐碱地和海岸附近的植物中含有碳酸钠,可以从植物的灰烬中提取;当冬季来临时,碱湖中所含的碳酸钠结晶析出,经过简单的加工就可以使用。
世界上最早是通过路布兰法实现了碳酸钠的工业生产。其生产原理是:
用硫酸将食盐转变成硫酸钠
NaCl+H2SO4
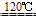 NaHSO4+HCl↑NaCl+NaHSO4
NaHSO4+HCl↑NaCl+NaHSO4 Na2SO4+HCl↑
Na2SO4+HCl↑ 将硫酸钠与木炭、石灰石一起加热,反应生成碳酸钠和硫化钙
Na2SO4+2C
 Na2S+2CO2↑ Na2S+CaCO3
Na2S+2CO2↑ Na2S+CaCO3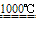 Na2CO3+CaS
Na2CO3+CaS 存在原料利用不充分、成本较高、设备腐蚀严重等
氨碱法生产硫酸:
氨碱法是由比利时人索尔维发明的,所以,氨碱法也称为索尔维制碱法。氨碱法的原料也是氯化钠和碳酸钙,不同的是它还使用了炼焦的副产品氨。
原料:CaCO3、NaCl、NH3
1.生成碳酸氢钠和氯气铵
将CO2通入含NH3的饱和NaCl溶液中
NH3+CO2+H2O==NH4HCO3 NaCl+NH4HCO3==NaHCO3↓+NH4Cl
2.抽取碳酸钠2NaHCO3
 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑ 氨碱法生产原理:

氨碱法的优点:原料便宜易得,氨和部分二氧化碳可循环利用,产品纯度高,步骤简单。氨碱法的缺点:副产物氯化钙的处理问题,氯化钠的利用率低。
联合制碱法:
我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称联合制碱法或侯德榜制碱法,副产品的一种用途为化肥或电解液或焊药等。
(2)沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
(3)写出上述流程中X物质的分子式CO2。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了I 的循环。从沉淀池中取出沉淀的操作是过滤
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:
①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺;这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
发现相似题
与“我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、...”考查相似的试题有:
- 联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:(1)X是______,Y是______(填化学式);______.(2)Z中除了溶解...
- 我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:(1)上述生产纯碱的方法称______,副产品的一种用...
- 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工...
- [三选一选修2:化学与技术]NaCl是价廉且应用广泛的化工业原料,例如,纯碱工业、氯碱工业、氯酸钾工业、肥皂工业等。(1)19...
- 我国化学家侯德榜改革国外的Na2CO3生产工艺,创造了侯氏制碱法,又叫联邦制碱法,该法是将合成氨工厂生产的NH3及副产品CO2,...
- 下列关于工业生产说法不正确的是( )A.电解精炼铜时,用粗铜做阴极,纯铜做阳极B.在硫酸工业、合成氨工业、硝酸工业中,皆...
- 以食盐为原料进行生产并综合利用的某些过程如下图所示。(1)除去粗盐中的Ca2+、Mg2+和SO42-,加入下列沉淀剂的顺序是(填序号...
- 绿色化学是20世纪90年代出现的一个多学科交叉的研究领域。它可以诠释为环境友好化学,其核心内涵是反应过程和化工生产中,尽...
- 化学无处不在,与化学有关的说法不正确的是( )A.侯氏制碱法的工艺过程中应用了物质溶解度的差异B.可用蘸浓盐酸的棉棒检验...
- 下列有关工业生产的叙述正确的是( )A.合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率B.硫酸工业中,...