本试题 “思思同学在总结“构造原理、能量最低原理、泡利原理、洪特规则”后得出了:“在同一原子里,没有运动状态完全相同的电子存在”的结论。你认为此结论是否正确,请...” 主要考查您对能量最低原理
泡利原理
洪特规则
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 能量最低原理
- 泡利原理
- 洪特规则
能量最低原理:
原子核外的电子应优先排布在能量最低的能级,然后由里到外,一次排布在能量逐渐升高的能级里。
能级能量高低的顺序为:1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
原子核外的电子应优先排布在能量最低的能级,然后由里到外,一次排布在能量逐渐升高的能级里。
能级能量高低的顺序为:1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
泡利原理:
在原子中不能容纳运动状态完全相同的电子。又称泡利原理、不相容原理引。
一个原子中不可能有电子层、电子亚层、电子云伸展方向和自旋方向完全相同的两个电子。如氦原子的两个电子,都在第一层(K层),电子云形状是球形对称、只有一种完全相同伸展的方向,自旋方向必然相反。每一轨道中只能容纳自旋相反的两个电子,每个电子层中可能容纳轨道数是n2个、每层最多容纳电子数是2n2个。
在原子中不能容纳运动状态完全相同的电子。又称泡利原理、不相容原理引。
一个原子中不可能有电子层、电子亚层、电子云伸展方向和自旋方向完全相同的两个电子。如氦原子的两个电子,都在第一层(K层),电子云形状是球形对称、只有一种完全相同伸展的方向,自旋方向必然相反。每一轨道中只能容纳自旋相反的两个电子,每个电子层中可能容纳轨道数是n2个、每层最多容纳电子数是2n2个。
洪特规则:
在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同,即为洪特规则,又称为最多轨道原理。
一般:电子总是尽先自旋平行地分占不同轨道。如:
碳原子的轨道表示是: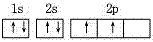 ,而不是
,而不是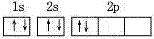
特别提醒:等价轨道全空(p0、d0、f0)和全满时(p6、d10、f14)的结构,也具有较低能量和较大的稳定性。像铁离子Fe3+(3d5)和亚铁离子Fe2+(3d6)对比看,从3d6→3d5才稳定,这和亚铁离子不稳定易被氧化的事实相符合。根据洪特规则铬的电子排布式应为 1s22s22p63s23p63d54s1。
在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同,即为洪特规则,又称为最多轨道原理。
一般:电子总是尽先自旋平行地分占不同轨道。如:
碳原子的轨道表示是:
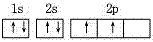 ,而不是
,而不是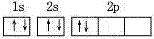
特别提醒:等价轨道全空(p0、d0、f0)和全满时(p6、d10、f14)的结构,也具有较低能量和较大的稳定性。像铁离子Fe3+(3d5)和亚铁离子Fe2+(3d6)对比看,从3d6→3d5才稳定,这和亚铁离子不稳定易被氧化的事实相符合。根据洪特规则铬的电子排布式应为 1s22s22p63s23p63d54s1。
发现相似题
与“思思同学在总结“构造原理、能量最低原理、泡利原理、洪特规则...”考查相似的试题有:
- 以下能级符号不正确的是( )A.3sB.3pC.3dD.3f
- 下列原子的外围电子排布中,哪一种状态的能量较低?试说明理由。(1)氮原子:_____________________________(2)钠原子:A.3s1B...
- 在d轨道中电子排布成,而不排成其直接根据是( )A.能量最低原理B.泡利不相容原理C.原子轨道能级图D.洪特规则
- [物质结构与性质]氧是地壳中含量最多的元素(1)氧元素基态原子核外未成对电子数为______个.(2)H2O分子内O-H键、分子间的...
- 以下符号正确的是( )A.2d1B.7p2C.6s3D.3f7
- 下列排布不符合泡利不相容原理的是[ ]A.2p能级:B.3d能级:C.2p能级:D.3d能级:
- 下列实验事实与原子结构模型建立的关系正确的是( )A.电子的发现:道尔顿的原子结构模型B.α粒子散射:卢瑟福原子结构模型C...
- (1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,哪些违反了泡利原理____________,哪些违反了洪特规则__...
- 简单原子的原子结构可用如图表示方法形象表示:其中●表示质子或电子,○表示中子,则下列有关①②③的叙述错误的是( )A.①②③属...
- 下列原子核外电子排布中,违背“泡利不相容原理”的是_________;违背“洪特规则”的是_______;违背“洪特 规则特例”的是________...