本试题 “下列说法正确的是[ ]A.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据B.物质发生化学变化时都伴随着能量变化C.活化分子之间发生...” 主要考查您对活化分子、活化能、有效碰撞
影响化学反应速率的因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 活化分子、活化能、有效碰撞
- 影响化学反应速率的因素
有效碰撞与活化分子:
1.化学反应过程就是反应物分子分裂成原子,原子重新组合成生成物分子的过程,也就是反应物分子中化学键断裂、生成物分子中化学键形成的过程。
2.旧键的断裂和新键的形成都是通过反应物分子 (或离子)的相互碰撞来实现的。反应物分子(或离子)问的碰撞是化学反应发生的先决条件,但并不是反应物分子的每次碰撞都能发生化学反应。
3.能够发生化学反应的分子碰撞叫做有效碰撞,把能够发生有效碰撞的分子叫做活化分子。活化分子具有比普通分子(非活化分子)更高的能量。活化分子在碰撞后有可能使原子问的化学键断裂,从而导致化学反应的发生。但并不是活化分子的每次碰撞都能引起化学反应。
4.分子间的自由碰撞必然会有不同的碰撞取向。研究发现,有效的分子碰撞,分子除了要有足够的能量以外,还要有合适的碰撞取向。从分子能量的方面来看,活化分子具备发生有效碰撞的条件。从分子碰撞取向的方向来看,活化分子的某次碰撞并不一定能引发化学反应。若活化分子碰撞取向合适,才能发生化学反应;若活化分子碰撞取向不合适,则化学反应不能发生。也就是说,只有活化分子以合适的取向发生碰撞,才能使分子内的化学键断裂,从而引发化学反应。或者说,具有较高能量的活化分子按照合适的取向所发生的有效碰撞才能引发化学反应。
5.为了把“有效碰撞”概念具体化,人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子所多出来的那部分能量叫做活化能,因此活化能是活化分子平均能量与普通反应物分子平均能量的差值。
6.活化能相当于化学反应的“门槛”,对于同一化学反应,其活化能越低,反应速率越快。催化剂就是通过参与反应,改变反应历程,降低反应的活化能来提高反应速率的。
1.化学反应过程就是反应物分子分裂成原子,原子重新组合成生成物分子的过程,也就是反应物分子中化学键断裂、生成物分子中化学键形成的过程。
2.旧键的断裂和新键的形成都是通过反应物分子 (或离子)的相互碰撞来实现的。反应物分子(或离子)问的碰撞是化学反应发生的先决条件,但并不是反应物分子的每次碰撞都能发生化学反应。
3.能够发生化学反应的分子碰撞叫做有效碰撞,把能够发生有效碰撞的分子叫做活化分子。活化分子具有比普通分子(非活化分子)更高的能量。活化分子在碰撞后有可能使原子问的化学键断裂,从而导致化学反应的发生。但并不是活化分子的每次碰撞都能引起化学反应。
4.分子间的自由碰撞必然会有不同的碰撞取向。研究发现,有效的分子碰撞,分子除了要有足够的能量以外,还要有合适的碰撞取向。从分子能量的方面来看,活化分子具备发生有效碰撞的条件。从分子碰撞取向的方向来看,活化分子的某次碰撞并不一定能引发化学反应。若活化分子碰撞取向合适,才能发生化学反应;若活化分子碰撞取向不合适,则化学反应不能发生。也就是说,只有活化分子以合适的取向发生碰撞,才能使分子内的化学键断裂,从而引发化学反应。或者说,具有较高能量的活化分子按照合适的取向所发生的有效碰撞才能引发化学反应。
5.为了把“有效碰撞”概念具体化,人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子所多出来的那部分能量叫做活化能,因此活化能是活化分子平均能量与普通反应物分子平均能量的差值。
6.活化能相当于化学反应的“门槛”,对于同一化学反应,其活化能越低,反应速率越快。催化剂就是通过参与反应,改变反应历程,降低反应的活化能来提高反应速率的。
影响化学反应速率的因素:
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为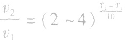
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释
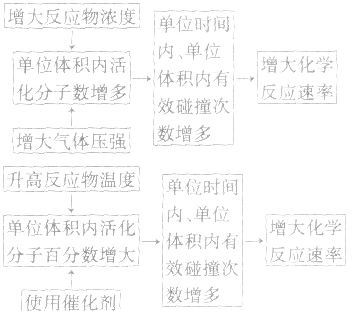
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
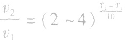
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释

发现相似题
与“下列说法正确的是[ ]A.热化学方程式中,如果没有注明温度和...”考查相似的试题有:
- 下列说法不正确的是[ ]A.纸层析通常把不与水混溶的有机溶剂作为流动相B.制摩尔盐时用酒精洗涤产品,而在制阿司匹林时用水洗...
- 为了研究外界条件对H2O2分解速率的影响,某同学做了以下实验,请回答下列问题.编号操作实验现象①分别在试管A、B中加入5mL5%H...
- 下列说法正确的是( )①为加快锌粉与稀硫酸制氢气的反应速率,可以加入少量的CuCl2固体②面粉厂严禁烟火的原因是面粉粉尘表面...
- 硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是反应温度/℃ Na...
- (1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者_________后者(填“<”、...
- 向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时, 按正反应速率由大到小的顺序排列,正确的是①500 ℃, 10 mol...
- 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:(1)定性分...
- 在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B) =0. 200 mol/L及c(C) =0 mol/L...
- 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )A.物质的量之...
- 已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:时...