本试题 “本世纪,人类社会将逐渐步入氢经济时代.目前大规模产氢方式仍是化学制氢.I、催化重整制氢以甲醇为例,反应制氢气的一般途径有:CH3OH(l)=2H2(g)+CO(g...” 主要考查您对燃料和能源(氢能、风能、核能、太阳能等)
化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 燃料和能源(氢能、风能、核能、太阳能等)
- 化学反应热的计算
燃料和能源:
1.能源的分类:

2.各种能源的特点:
(1)传统燃料。柴草是农村使用的重要能源,但它的利用率低,且污染严重。
(2)化石燃料。这是人们目前使用的主要能源,它们的蕴藏量有限,而且不能再生,最终会枯竭,属于不可再生能源。
(3)新能源。新能源来源丰富,多数可以再生,没有污染或污染很小,所以可能成为未来的主要能源,但它们也有自己的缺点,如太阳能的能量密度低,使用成本高;氢能储仔、运输困难;风能不稳定,受地区、季节、气候的影响大。
3.我国的能源状况
(1)能源种类。我国的能源种装有化石燃料、水能和核能,其中化石燃料和水能的人均值太低,核能—一铀已探日月的储量很低,仅够4000万干瓦核电站运行 30年。
(2)我国能源的总消费量和人均消费量从改革开放以来~直到1995年逐年增加,从1995年开始有减少的趋势。
(3)我国能源利用率低,只有9%,能源节约的空间很大。
4.使用化石燃料的利弊及新能源的开发
(1)燃料充分燃烧的两个条件:
①要有足够的空气;
②燃料与空气要有足够大的接触面积。
(2)重要的化石燃料:煤、石油、天然气
(3)煤作燃料的利弊问题:
①煤是重要的化工原料;
②煤直接燃烧时产生SO2等有毒气体和烟尘,对环境造成严重污染;
③煤作为固体燃料,燃烧反应速率小,热利用率低,且运输不方便;
④可以通过清洁煤技术,如煤的液化和气化以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。
(4)新能源的开发:
①调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发新能源等;
②现在正在探索的新能源有太阳能、地热能、海洋能、生物质能、风能和氢能等。
1.能源的分类:

2.各种能源的特点:
(1)传统燃料。柴草是农村使用的重要能源,但它的利用率低,且污染严重。
(2)化石燃料。这是人们目前使用的主要能源,它们的蕴藏量有限,而且不能再生,最终会枯竭,属于不可再生能源。
(3)新能源。新能源来源丰富,多数可以再生,没有污染或污染很小,所以可能成为未来的主要能源,但它们也有自己的缺点,如太阳能的能量密度低,使用成本高;氢能储仔、运输困难;风能不稳定,受地区、季节、气候的影响大。
3.我国的能源状况
(1)能源种类。我国的能源种装有化石燃料、水能和核能,其中化石燃料和水能的人均值太低,核能—一铀已探日月的储量很低,仅够4000万干瓦核电站运行 30年。
(2)我国能源的总消费量和人均消费量从改革开放以来~直到1995年逐年增加,从1995年开始有减少的趋势。
(3)我国能源利用率低,只有9%,能源节约的空间很大。
4.使用化石燃料的利弊及新能源的开发
(1)燃料充分燃烧的两个条件:
①要有足够的空气;
②燃料与空气要有足够大的接触面积。
(2)重要的化石燃料:煤、石油、天然气
(3)煤作燃料的利弊问题:
①煤是重要的化工原料;
②煤直接燃烧时产生SO2等有毒气体和烟尘,对环境造成严重污染;
③煤作为固体燃料,燃烧反应速率小,热利用率低,且运输不方便;
④可以通过清洁煤技术,如煤的液化和气化以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。
(4)新能源的开发:
①调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发新能源等;
②现在正在探索的新能源有太阳能、地热能、海洋能、生物质能、风能和氢能等。
应用盖斯定律进行计算的方法:
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
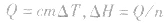
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
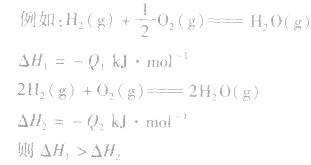
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即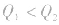 .
.
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
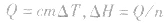
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
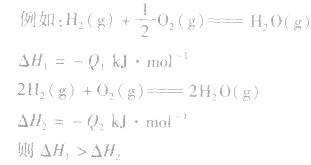
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
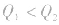 .
. 发现相似题
与“本世纪,人类社会将逐渐步入氢经济时代.目前大规模产氢方式...”考查相似的试题有:
- 下列说法正确的是[ ]A.脂肪烃、芳香烃和卤代烃都属于烃B.天然气、沼气和水煤气都属于可再生的清洁能源C.工业上分别用热还...
- 下列叙述中,正确的是[ ]A.光导纤维广泛应用于现代通讯,制造光导纤维的主要原料是SiB.二氧化碳不宜用于扑灭金属钠燃烧引起...
- 下列关于能源和作为能源物质的叙述中不正确的是[ ]A.人类利用的能源都是通过化学反应获得的B.绿色植物进行光合作用时,将太...
- 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列不属于未来新能源标准的是( )①天然气 ②煤 ...
- 曾经有两条新闻引起全国人民的广泛关注:{1}2003年5月25日,中央电视台《新闻联播》报道,“西气东输”工程进展迅速,2004年东...
- 石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。以下解决能源问题的方法不当的是[ ]A.用木材作燃料B.用液氢替...
- 1molC、1molCO分别按下式反应,回答下列问题:C(S)+1/2O2(g)=CO(g) 放出110.5KJ热量 CO(g)+1/2O2(g)=CO2(g) 放出...
- 已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H1=―Q1KJ/mol2H2(g)+O2(g)==2H2O(g) △H2= ―Q2KJ/mol2H2(g)+O2(g)==2H2O(1) △H3= ―Q3KJ...
- 已知:现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(1),若实验测得反应放热3695 kJ,则原混合气体中H...
- 化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:H(g)+I(g)→H-I(g)+297kJ 即H-I键的键能为297kJ·mol-1,也可以理...