本试题 “下列叙述正确的是[ ]A.电镀时,通常把待镀的金属制品作阳极B.上图中电子由Zn极流向Cu,盐桥中的Cl–移向CuSO4溶液C.氢氧燃料电池(酸性电解质)中O2通入正极...” 主要考查您对原电池原理
电镀
金属的电化学防护
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原电池原理
- 电镀
- 金属的电化学防护
原电池:
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例
(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
电镀:
(1)概念:应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。
(2)目的:使金属增强抗腐蚀能力,增加美观和表面硬度。镀件(待镀金属制品)作阴极
(3)要求
如在铁制品表面上镀铜: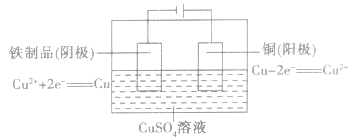
注意:理论上,电镀过程中电镀液的浓度保持不变。
电化学防护:
(1)外加电流的阴极保护法。如把金属连接在电源的负极上,这样就能消除引起金属腐蚀的原电池反应。
(2)牺牲阳极的阴极保护法。如在金属上铆接比它更活泼的另一种金属,发生金属腐蚀时是较活泼的金属被腐蚀而金属本身受到保护。
(1)外加电流的阴极保护法。如把金属连接在电源的负极上,这样就能消除引起金属腐蚀的原电池反应。
(2)牺牲阳极的阴极保护法。如在金属上铆接比它更活泼的另一种金属,发生金属腐蚀时是较活泼的金属被腐蚀而金属本身受到保护。
发现相似题
与“下列叙述正确的是[ ]A.电镀时,通常把待镀的金属制品作阳极B...”考查相似的试题有:
- 一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是( )A.CH3OH(g)+O...
- 关于下列各装置图的叙述中,正确的是( )A.实验室用装置①制取氨气B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸C....
- 中国科技大学的研究人员于2010年9月14日宣布,验证了通过电化学催化重整方法,可从生物油有效地生产氢气.这一工作成果已发布...
- (8分)某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:(已知果汁是显酸性的)实...
- Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3 AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说...
- 各图所示装置属于原电池的是( )A.B.C.D.
- 如图所示,用铁棒和石墨棒作电极电解1L 1mol/L食盐水,下列有关说法 正确的是 ( )A.电键K与N连接,铁棒被保护而免受腐蚀B...
- 下列判断中正确的是A.烧杯a中的溶液pH升高B.锌是化学电源的正极C.烧杯a中发生的反应为2H++2e-=H2↑D.盐桥中的阳离子向铁电...
- (1)在实验室里可以用浓盐酸跟二氧化锰起反应制取氯气,反应的化学方程式为:____________________________________________...
- 以下现象与电化学腐蚀无关的是( )A.黄铜(铜锌合金)制作的铜锣不易产生铜绿B.生铁比软铁芯(几乎是纯铁)容易生锈C.铁...