本试题 “(9分)用中和滴定法测定某烧碱的浓度。请回答在主要操作过程中的有关问题:(1)将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。将0.20m...” 主要考查您对水的离子积常数
水电离的影响因素
水的电离平衡
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水的离子积常数
- 水电离的影响因素
- 水的电离平衡
水的电离:
水是一种极弱的电解质,它能微弱地电离:
实验测得:25℃时,1L纯水中只有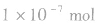 的水分子发生电离,故25℃时纯水中
的水分子发生电离,故25℃时纯水中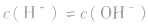

水的离子积:
在一定温度下,水电离出的c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积,用符号 表示,即
表示,即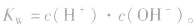
(1)在一定温度下,水的离子积都是一个常数,在25℃时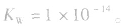
(2)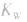 随温度的变化而变化,温度升高,
随温度的变化而变化,温度升高,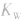 增大。
增大。
(3)水的离子积常数揭示了在任何水溶液中均存在水的电离平衡,都有 存在。在酸性或碱性的稀溶液中,当温度为25℃时,
存在。在酸性或碱性的稀溶液中,当温度为25℃时,
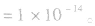
(4)在酸或碱的稀溶液中,由水电离出的c(H+)和c(OH-)总相等.即 如25℃时
如25℃时 或NaOH溶液中,
或NaOH溶液中,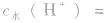
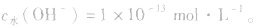
溶液中c(H+)或c(OH-)的计算:
常温下,稀溶液中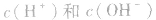 的乘积总是
的乘积总是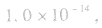 知道
知道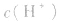 就可以计算出
就可以计算出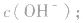 反之亦然
反之亦然
1.酸溶液
当在水中加入酸后,将使水的电离平衡向左移动 (抑制水的电离)。在酸的水溶液中,H+主要由酸电离产生,即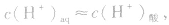 而OH-是由水电离产生的:
而OH-是由水电离产生的: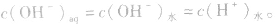
2.碱溶液
同理,在碱的水溶液中,OH-主要由碱电离产生,即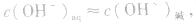 而H+是由水电离产生的:
而H+是由水电离产生的: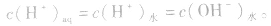
3.盐溶液
在盐的水溶液中,H+和OH-全部来自水的电离,且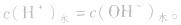
(1)若单一水解的盐的水溶液呈酸性,c(H+)> c(OH-),即弱碱阳离子水解


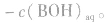
(2)若单一水解的盐的水溶液呈碱性,c(OH一)> c(H+),即弱酸阴离子水解
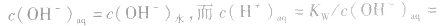
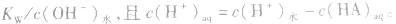
说明:由以上分析可以看出,在常温下(25℃):
酸(或碱)的溶液中,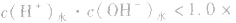
 发生水解的盐溶液中
发生水解的盐溶液中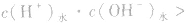
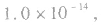 但
但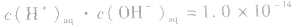 总成立。
总成立。
影响水电离平衡的因素:
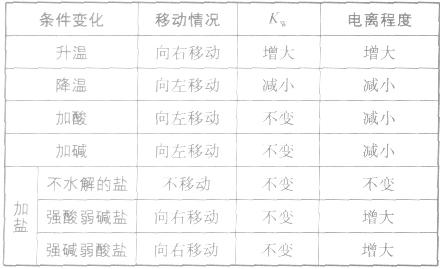
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
发现相似题
与“(9分)用中和滴定法测定某烧碱的浓度。请回答在主要操作过程...”考查相似的试题有:
- (9分)用中和滴定法测定某烧碱的浓度。请回答在主要操作过程中的有关问题:(1)将1.70g含有少量杂质(不与盐酸反应)的固体烧...
- 重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是A.重水的pD=7.0B.含0...
- (1)①常温下,pH=3的盐酸和pH=11的氢氧化钡等 体积混合,溶液的pH= 。②常温下pH=3的盐酸和pH=6的盐酸等体积混合,溶液的pH= ...
- 叠氮酸(HN3)与醋酸的酸性相似,下列叙述中错误的是A.HN3水溶液中粒子浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-)B.若HN3比...
- 水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项.关于水的下列说法正确的是( ) A.水可以电离出离子,所以...
- (14分)已知某无色透明溶液中仅含有包括Na+和CH3COO-在内的四种离子。请回答下列问题。(1)该溶液中的溶质可能有三种情况,...
- 25℃时,水中存在电离平衡:H2OH++OH- △H>0。下列叙述正确的是[ ]A. 将水加热,Kw增大,pH不变B. 向水中加入少量NaHSO4固体,c...
- 醋酸是重要的一元酸,在有机和无机反应中都有应用.现有25℃时pH=3的醋酸。请回答下列问题:(1)若向醋酸中加入少量醋酸钠固...
- 25℃时,水的电离平衡:H2OH++OH— △H>0,下列叙述正确的是( )A.向水中加入稀氨水,平衡逆向移动,c(OH—)降低B.向水中加入...
- 常温下,要使0.1mol•L-1醋酸的电离程度和pH都减小,同时又使醋酸根离子浓度增大,可加入的试剂是:( )A.CH3COONa浓溶液B...