本试题 “某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定...” 主要考查您对无机推断
单质铁
氧化铁
单质铜
氧化铜
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 无机推断
- 单质铁
- 氧化铁
- 单质铜
- 氧化铜
无机推断的解题题眼:
1.题眼一:
常见气体单质气体:H2、O2、N2、Cl2(黄绿色)、F2(淡黄绿色)
气态氢化物:NH3(无色有刺激性气味,易液化,极易溶于水,能使湿润的红色石蕊试纸变蓝,遇到HCl形成白烟)
HCl(无色有刺激性气味,极易溶于水,能使湿润的蓝色石蕊试纸变红,在空气中形成白雾,遇到NH3形成白烟)
H2S(无色有臭鸡蛋气味,蛋白质腐败的产物,能溶于水,能使湿润的醋酸铅试纸变黑)
非金属气态氧化物:CO、CO2(直线型非极性分子)、NO(遇到空气变红棕色)、NO2(红棕色,加压、降温会转变成无色N2O4)、SO2(无色、有刺激性气味、能使品红溶液褪色) [固态氧化物]:SO3(无色晶体、易挥发)、P2O5(白色固体、易吸湿,常用作干燥剂)、SiO2(不溶于水、不溶于普通酸的高熔点固体,但溶于氢氟酸和强碱溶液)
气态卤代烃:一氯甲烷(CH3Cl)、氯乙烯(CH2=CHCl)气态醛:甲醛(HCHO)
2.题眼二:
气体溶解性归纳难溶于水的:H2、N2、CO、NO、CH4、C2H4;
微溶于水的:O2、C2H2;
能溶于水的:Cl2(1:1)、H2S(1:2.6)、SO2(1:40);
极易溶于水的:NH3(1:700)、HCl(1:500)、HF、HBr、HI。
3.题眼三:
常见液态物质无机物:液溴Br2、水(H2O)、过氧化氢(H2O2)、二硫化碳(CS2)、三氯化磷(PCl3)
有机物:一般5个碳原子以上的低级烃;除一氯甲烷、氯乙烯之外的低级卤代烃;低级醇;除甲醛之外的低级醛;低级羧酸;低级酯。
4.题眼四:
常见物质的颜色
①红色:Fe(SCN)3(红色溶液); Cu2O(红色固体);Fe2O3(红棕色固体); 液溴(深红棕色);Fe(OH)3(红褐色固体);Cu(紫红色固体);溴蒸气、NO2(红棕色)
②紫色:Fe3+与苯酚反应产物(紫色);I2(有金属光泽紫黑色固体)KMnO4固体(紫黑色);MnO4-(紫红色溶液) 钾的焰色反应(紫色) I2蒸气、I2在非极性溶剂中(紫色)
③橙色:溴水(橙色) K2Cr2O7溶液(橙色)
④黄色:AgI(黄色固体);AgBr(淡黄色固体); FeS2(黄色固体);Na2O2(淡黄色固体);S(黄色固体);I2的水溶液(黄色);Na的焰色反应(黄色);工业浓盐酸(黄色)(含有Fe3+);Fe3+的水溶液(黄色);久置的浓硝酸(黄色)(溶有分解生成的NO2);浓硝酸粘到皮肤上(天然蛋白质)(显黄色);
⑤绿色:Cu2(OH)2CO3(绿色固体);Fe2+的水溶液(浅绿色);FeSO4?7H2O(绿矾);Cl2、氯水(黄绿色);F2(淡黄绿色); CuCl2的浓溶液(蓝绿色);
⑥棕色:FeCl3固体(棕黄色);CuCl2固体(棕色)
⑦蓝色:Cu(OH)2、CuSO4?5H2O、Cu2+在水溶液中(蓝色);淀粉遇I2变蓝色; Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色);
⑧黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS; AgCl、AgBr、AgI、AgNO3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。
⑨白色:常见白色固体物质如下(呈白色或无色的固体、晶体很多):AgCl;Ag2CO3;Ag2SO4;Ag2SO3;BaSO4;BaSO3;BaCO3;CaCO3;MgO;Mg(OH)2;MgCO3;Fe(OH)2;AgOH;PCl5;SO3;三溴苯酚;铵盐(白色固体或无色晶体); Fe(OH)2沉淀在空气中的现象:白色→(迅速)灰绿色→(最终)红褐色
5.题眼五:
根据框图中同一元素化合价的变化为主线,即A→B→C→……型归纳
C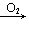 CO
CO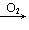 CO2;H2S
CO2;H2S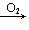 S
S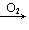 SO2
SO2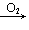 SO3(H2SO4); NH3(N2)
SO3(H2SO4); NH3(N2) NO
NO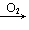 NO2→HNO3; Na
NO2→HNO3; Na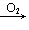 Na2O
Na2O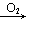 Na2O2; Fe→Fe2+→Fe(OH)2
Na2O2; Fe→Fe2+→Fe(OH)2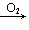 Fe(OH)3;Fe→Fe2+→Fe3+;
Fe(OH)3;Fe→Fe2+→Fe3+;
CH2=CH2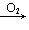 CH3CHO
CH3CHO CH3COOH;CH3CH2OH
CH3COOH;CH3CH2OH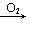 CH3CHO
CH3CHO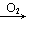 CH3COOH
CH3COOH
6.题眼六:
根据化学反应形式
(1)根据置换反应“单质+化合物=新的单质+新的化合物” 进行推理
㈠金属置换金属
铝热反应:需高温条件才能引发反应的发生,通常用来冶炼一些高熔点金属。如:2Al+Fe2O3 Al2O3+2Fe; 8Al+3Fe3O4
Al2O3+2Fe; 8Al+3Fe3O4 4Al2O3+9Fe
4Al2O3+9Fe
㈡.金属置换非金属
①金属与水反应置换出H2 2Na+2H2O==2Na++2OH-+H2↑ (非常活泼的金属在常温下与H2O反应) 3Fe+4H2O Fe3O4+4H2↑
Fe3O4+4H2↑
②金属与非氧化性酸(或氧化物)反应 2Al+6H+==2Al3++3H2↑;2Mg+CO2 2MgO+C
2MgO+C
㈢.非金属置换非金属
①非金属单质作氧化剂的如:2F2+2H2O==4HF+O2;2FeBr2+3Cl2==2FeCl3+2Br2;X2+H2S==2H++2X-+S↓(X2=Cl2、Br2、I2);2H2S+O2(不足)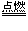 2S+2H2O (H2S在空气中不完全燃烧) 2H2S+O2==2S↓+2H2O(氢硫酸久置于空气中变质)
2S+2H2O (H2S在空气中不完全燃烧) 2H2S+O2==2S↓+2H2O(氢硫酸久置于空气中变质)
②非金属单质作还原剂的如:C+H2O CO+H2 (工业上生产水煤气的反应) Si+4HF==SiF4(易挥发)+2H2↑
CO+H2 (工业上生产水煤气的反应) Si+4HF==SiF4(易挥发)+2H2↑
㈣.非金属置换金属
如:2CuO+C 2Cu+CO2↑
2Cu+CO2↑
①根据反应“化合物+化合物=单质+化合物”进行推理,常见的该类型反应有:
2Na2O2+2H2O==4NaOH+O2↑
2Na2O2+2CO2==2Na2CO3+O2
2H2S+SO2==3S↓+2H2O
KClO3+6HCl(浓)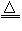 KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
MnO2+4HCl(浓)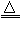 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②根据反应“一种物质三种物质”进行推理,常见该类型的反应有:
Cu2(OH)2CO3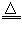 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
2KMnO4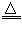 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
NH4HCO3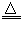 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
(NH4)2CO3 2NH3↑+CO2↑+H2O
2NH3↑+CO2↑+H2O
NH4HSO3 NH3↑+SO2↑+H2O
NH3↑+SO2↑+H2O
③根据反应“化合物+单质==化合物+化合物+……”,常见该类型的反应有:
Na2SO3+Cl2+H2O==Na2SO4+2HCl
Na2SO3+Br2+H2O==Na2SO4+2HBr
C+4HNO3(浓)==CO2↑+4NO2↑+2H2O
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
7.题眼七:
根据常见反应的特征现象。
(1)两种物质反应既有沉淀又有气体生成的
①双水解:主要指Al3+、Fe3+与CO32-、HCO3-等之间的双水解
②Ba(OH)2和(NH4)2SO4生成氨气和硫酸钡沉淀
(2)遇水能放出气体的
①Li、Na、K、Ca、Ba、Mg(△)、Fe(高温)[氢后面的金属不跟水反应]
②Na2O2、NaH、CaC2、Al2S3、Mg3N2
③加碱能产生气体的:Al、Si、NH4+
④加酸有沉淀生成的:如SiO32-、AlO2-、S2O32-、C6H5O-(常温下)
⑤有“电解”条件的,通常联想到下列代表物:
a.电解电解质型:不活泼金属的无氧酸盐如CuCl2(aq)
b.放氧生酸型:不活泼金属的含氧酸盐如CuSO4(aq)
c.放氢生碱型:活泼金属的无氧酸盐如NaCl(aq)
d.电解熔融离子化合物:如Al2O3(l)、NaCl(l)
无机推断题的突破方法:
解决无机框图推断题的一般流程是:
整体浏览、寻找突破;
由点到面、广泛联系;
大胆假设、验证确认;
明确要求、规范解答 。
解题的关键是仔细审题,依据物质的特征来寻找突破口,顺藤摸瓜,进而完成全部未知物的推断。常用的突破方法主要有以下几种。
1.依据元素或物质的特征数据突破
常用的有:
(1)在地壳中含量最多的元素是氧;
(2)在地壳中含量最多的金属元素是铝;
(3)组成化合物种类最多的元素是碳;
(4)相对分子质量最小的单质是氢气;
(5)日常生活中应用最广泛的金属是铁。
2.依据物质的特性突破
常用的有:
(1)使淀粉变蓝的是I2;
(2)能使铁、铝钝化的是冷的浓硫酸或浓硝酸;
(3)能与SiO2反应而能雕刻玻璃的是氢氟酸;
(4)能使品红溶液褪色,褪色后的溶液受热后恢复红色的是二氧化硫;
(5)遇SCN-溶液变红色的是Fe3+;
(6)在放电的条件下与氧气化合生成NO的是氮气;
(7)能与水剧烈反应生成氧气的气体是F2;
(8)具有磁性的黑色固体是Fe3O4;
(9)红棕色粉末是Fe2O3;
(10)黄绿色气体是Cl2,红褐色沉淀是Fe(OH)3,能与水反应放出气体的淡黄色粉末是Na2O2。
3.依据物质的特殊用途突破
常用的有:
(1)可作呼吸面具和潜水艇中的供氧剂的是Na2O2;
(2)可用于杀菌、消毒、漂白的物质主要有Cl2、ClO2、NaClO和漂白粉等;
(3)可用作半导体材料、太阳能电池的是晶体硅;
(4)用于制造光导纤维的是SiO2;
(5)可用于治疗胃酸过多的物质是NaHCO3、Al(OH)3等;
(6)可用于制造发酵粉的是NaHCO3;
(7)可用作钡餐的是BaSO4;
(8)可用于焊接钢轨、冶炼难熔金属的是铝热剂;
(9)可用作感光材料的是AgBr;
(10)可用作腐蚀印刷电路板的是FeCl3溶液。
4.依据特殊现象突破
常用的有:
(1)燃烧时产生苍白色火焰的是氢气在氯气中燃烧;
(2)灼烧时火焰呈黄色的是含钠元素的物质;
(3)灼烧时火焰呈紫色(透过蓝色钴玻璃)的是含钾元素的物质;
(4)在空气中迅速由无色变红棕色的气体是NO;
(5)白色沉淀迅速变为灰绿色,最后变为红褐色的是Fe(OH)2转化为Fe(OH)3;
(6)能使湿润的红色石蕊试纸变蓝色的气体是NH3;
(7)使澄清石灰水先变浑浊后变澄清的是CO2、SO2;
(8)加入NaOH溶液先产生白色沉淀后沉淀溶解的溶液中含有Al3+。
5.根据限定条件和解题经验突破
常用的有:
(1)“常见金属”往往是铁或铝;
(2)“常见气体单质”往往是H2、N2、O2、Cl2;
(3)“常用的溶剂”往往是H2O;
(4)“常温常压下为液态”的往往是H2O;
(5)“能与过量HNO3反应”则意味着某元素有变价;
(6)“与浓酸反应”的物质往往是铜、碳、MnO2等;
(7)“电解”生成三种物质的往往为NaCl溶液或CuSO4溶液或AgNO3溶液;“电解”生成两种物质的往往是电解水型的溶液,生成的两种物质为氢气和氧气。熔融电解往往是电解Al2O3、NaCl或MgCl2。
无机物间的特殊转化关系:


二、三角型转化
1.铁三角: 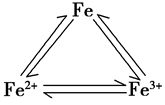
2.铝三角: 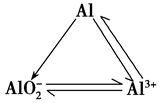
3.氯三角: 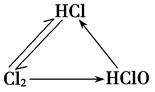
4.硅三角: 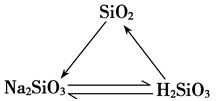
三、交叉型转化关系
1.硫及其重要化合物间的转化 :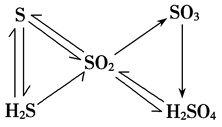
2.氮及其重要化合物间的转化 :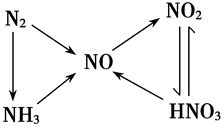
3.钠及其重要化合物间的转化 :



铁元素:
在元素周期表中的位置:铁的原子序数26,位于周期表中第四周期,第Ⅷ族。
(1)物理性质:银白色、有金属光泽,密度较大,熔点较高,硬度较小,具有导电、导热、延展性,可被磁铁吸引。
(2)化学性质:较活泼的金属,+2、+3价两种价态
①与强氧化剂反应(如:Cl2 Br2 过量稀HNO3)生成+3价铁的化合物。如: 
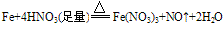
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S I2 H+ Cu2+)生成+2价铁的化合物,如: 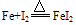
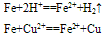
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁的性质:
- 物理性质:铁是黑色金属,具有铁磁性
- 铁的化学性质:
①与强氧化剂反应(如:Cl2、 Br2 、过量稀HNO3)生成+3价铁的化合物。如:
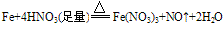
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S、 I2 、H+ 、Cu2+)生成+2价铁的化合物,如: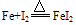
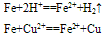
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁与稀硝酸的反应:
- 铁少量时:
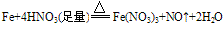
- 铁过量时:3Fe+8HNO3==3Fe(NO3)2+2NO+4H2O
两式可通过2Fe3++Fe==3Fe2+联系起来。
注意:
- 铁元素性质活泼,自然界中的铁元素几乎都是以化合态存在,只有在陨石中存在游离态的铁元素。
- 过量的铁与氯气反应,不会生成FeCl2,因为铁还原三价铁必须在水溶液中进行。
- 金属与强氧化性酸反应,不会生成H2。
化学性质:
铁元素性质活泼,有较强的还原性。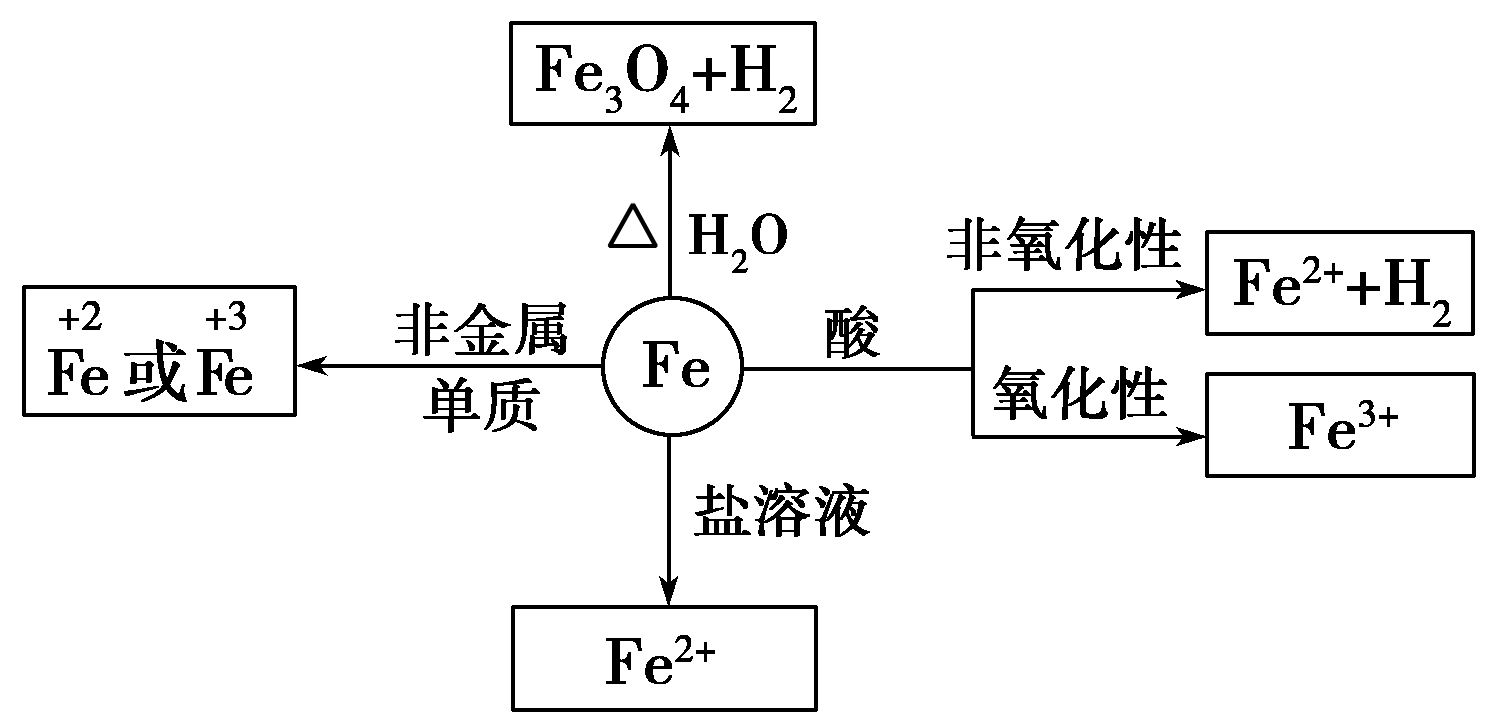
铁三角关系:

氧化铁:
化学式Fe2O3,溶于盐酸,为红棕色粉末。其红棕色粉末为一种低级颜料,工业上称氧化铁红,用于油漆、油墨、橡胶等工业中,可做催化剂,玻璃、宝石、金属的抛光剂,可用作炼铁原料。
(1)色态:红色粉末,俗称铁锈(铁红)
(2)溶解性:溶于盐酸、稀硫酸生成+3价铁盐;难溶于水,不与水反应。
(3)氧化性:高温下被CO、H2、Al、C、Si等还原
氧化铁的化学性质:
- 铝热反应:2Al+Fe2O3=(高温)=Al2O3+2Fe
- 与强酸反应:Fe2O3+6H+==2Fe3++3H2O
- 与还原性酸(HI)反应:Fe2O3+6H++2I-==2Fe2++3H2O+I2
铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
铜元素:
在元素周期表中的位置:铜的原子序数29,位于周期表中第四周期,第IB族。
(1)物理性质:有金属光泽,紫红色固体,密度较大,导电导热性能很好,具有很好的延展性,铜属于重金属、有色金属、常见金属,不能被磁铁吸引。
(2)化学性质: 铜常见的化合价为+1价和+2价
①在加热条件下,铜可与多种非金属单质反应。一般来说,遇到氧化性较弱的非金属,铜显较低化合价;遇到氧化性较强的非金属,铜显较高化合价。例如:与强氧化剂反应(如Cl2 Br2等)生成+2价铜的化合物。如:
Cu+Cl2 CuCl2 2Cu+O2
CuCl2 2Cu+O2 2CuO
2CuO
②铜与酸反应:铜只能被氧化性酸中的中心元素氧化。例如: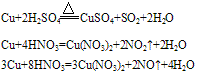
③铜与盐溶液反应:
Cu+2AgCl CuCl2+2Ag
CuCl2+2Ag
铜与铁的对比:
从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au可知,金属铁的金属活性比铜强,所以单质Fe可以从Cu的溶液中还原出单质来,例如: Fe+CuCl2 FeCl2+Cu
FeCl2+Cu
即Fe的还原性强于Cu
铜与浓硫酸和稀硫酸的反应:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2Cu+O2+2H2SO4(稀) 2CuSO4+2H2O
2CuSO4+2H2O
注意:从金属活性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au 可知,铜不能与稀硫酸发生反应,但是在有氧气和加热的条件下可以反应
铜与铜的化合物之间的转换图: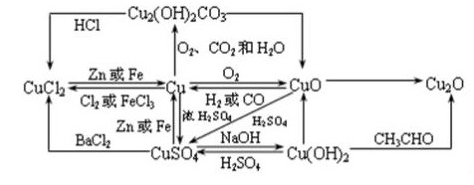
铜的制备和精炼:
(1)工业炼铜法:CuO+CO Cu+CO2
Cu+CO2
(2)湿法炼铜:Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
(3)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
备注:粗铜中铜的的含量为99.5%-99.7%,主要含有Ag、Zn、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%-99.98%的铜,原理为用粗铜作阳极,失去电子变为Cu2+,用纯铜棒作阴极即可得精铜。
氧化铜:
(1)物理性质:氧化铜是不溶于水的黑色固体(粉末),能溶于烯酸中,主要用于制造人造丝、陶瓷、釉、电池、杀虫剂,也用于制氢,做催化剂使用。
(2)化学性质:①氧化铜有金属氧化物的性质,常温下能与烯酸反应:CuO+2H+ Cu2++H2O
Cu2++H2O
②氧化铜具有氧化性,加热条件下可以与还原剂发生氧化还原反应:H2+CuO Cu+H2O
Cu+H2O
③氧化铜在高温下可发生分解反应:4CuO 2Cu2O+O2↑
2Cu2O+O2↑
(3)冶炼:一般通过加热分解Cu(OH)2的方式得到CuO,化学方程式为:Cu(OH)2 CuO+H2O
CuO+H2O
注意: 溶液中的Cu2+常为蓝色(浓CuCl2溶液呈绿色,稀CuCl2溶液呈蓝色),其颜色可作为Cu2+的判断依据。Cu2+与碱发生反应生成蓝色沉淀Cu(OH)2,其溶于氨水形成蓝色溶液。
氧化铜的特性:
| 气味 | 无味 |
| 颜色 | 黑色或者棕黑色 |
| 外观 | 无定形或结晶性粉末 |
| 性状 | 稍有吸湿性 |
| 相对质量 | 79.55 |
| 溶解性(水) | 不可溶 |
| 溶解度 | 不溶于水和乙醇,溶于酸、氯化铵及氰化钾溶液,氨溶液中缓慢溶解 |
| 稳定性 | 稳定 |
| 储存 | 密封干燥保存 |
| 用途 | 做有机反应的催化剂,制作人造丝和其他铜化合物等 |
氧化铜和氢氧化铜的性质比较:
名称
氧化铜
氢氧化铜
化学式
CuO
Cu(OH)2
物理性质
不溶水的黑色固体(粉末)
不溶于水的蓝色固体
化学性质
CuO+2H+
 Cu2++H2O
Cu2++H2O
CuO+H2 Cu+H2O
Cu+H2O
CuO+CO Cu+CO2
Cu+CO2Cu(OH)2+2H+  Cu2++2H2O
Cu2++2H2O
Cu(OH)2 CuO+H2O
CuO+H2O
Cu(OH)2+4NH3·H2O Cu(NH3)4(OH)2+4H2O
Cu(NH3)4(OH)2+4H2O
制法
Cu(OH)2
 CuO+H2O
CuO+H2OCu2++2OH-  Cu(OH)2↓
Cu(OH)2↓
例题:铜在自然界存在于多种矿石中,如:黄铜矿(CuFeS2)、斑铜矿(Cu5FeS4)、辉铜矿(Cu2S)、孔雀石(CuCO3·Cu(OH)2
请回答下列问题:
(1)、上表所列铜化合物中,铜的质量百分含量最高的是__Cu2S
)、工业上以黄铜矿为原料。采用火法熔炼工艺生产铜。改工艺的中间过程会发生反应:
2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是Cu2S和Cu2O
6Cu+SO2↑,反应的氧化剂是Cu2S和Cu2O
(3)、二氧化硫尾气直接排放到大气中造成环境污染的后果是形成酸雨,会对植物和建筑物等造成严重危害;该尾气可得到有价值的化学品,写出其中1中酸和1中盐的名称硫酸、硫酸钠。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需要进一步采用电解法精制。请简述粗铜电解得到精铜的大批量:以硫酸铜-硫酸溶液为电解质。电解时,粗铜(阳极)中的铜以及比铜活泼的金属失去电子进入溶液,不如铜活泼的金属沉入电解槽形成“阳极泥”;溶液中的Cu2+得到电子沉积在纯铜(阴极)上。
氧化铜与铜化合物之间的转换图:
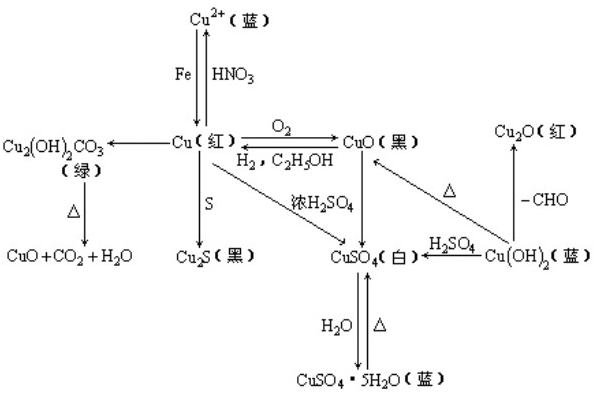
需要记住这些单质、化合物的颜色和状态,可以做为实验题的切入点。
知识扩展:
溶液中的Cu2+常为蓝色(浓CuCl2溶液呈绿色,稀CuCl2溶液呈蓝色),其颜色可作为Cu2+的判断依据。Cu2+与碱发生反应生成蓝色沉淀Cu(OH)2,其溶于氨水形成蓝色溶液。
反应方程为:CuCl2+2NaOH Cu(OH)2↓+2NaCl;Cu(OH)2+4NH3·H2O
Cu(OH)2↓+2NaCl;Cu(OH)2+4NH3·H2O Cu(NH3)4(OH)2+4H2O
Cu(NH3)4(OH)2+4H2O
与“某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。...”考查相似的试题有:
- 某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁...
- (12分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,...
- M、N、X、Y四种物质之间有如图转化关系(反应条件和其它产物已略去).下列选项不符合的是( )A.M:MaOH X:CO2B.M:HNO3 ...
- A、B、C、D、E、F是中学化学中常见的气体,G是一种固体非金属单质,它们具有如下的性质:①A、B、E能使湿润的蓝色石蕊试纸变红...
- 下列物质在常温下可用铁质容器盛放的是A.亚硫酸B.浓硫酸C.浓盐酸D.胆矾溶液
- 把铜粉和过量的铁粉加入到热的浓硝酸中,充分反应后,溶液中大量存在的金属阳离子是 ( )A.只有Fe2+B.只有Fe3+C.有Fe2+和...
- 有4.8 g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28 g,反应后全部气体用0.6 mol·L-1Ba(OH)2溶液100 mL吸收。下列有关...
- 氧化还原反应在工农业生产和日常生活中有广泛运用。(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维...
- 铁及其化合物之间的相互转化可用下式表示:回答下列有关问题:(1)铁元素在周期表中的位置是___________________________。...
- 某学习小组拟通过实验探究绿矾(FeSO4·7H2O)热分解的产物。【实验前准备】(1)理论分析 小组成员从理论上分析,认为下列分...