本试题 “某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下有关物质的部分物理性质如下实验步骤:(1)在250 mL锥形瓶中,加入9 gKOH和9mL水,配成溶液,冷...” 主要考查您对醛的通性
其他物质的制备(硫酸铜晶体、铁红等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 醛的通性
- 其他物质的制备(硫酸铜晶体、铁红等)
醛类:
1.官能团: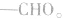 醛基总是在碳链的端点而不可能在两个碳原子之间。醛基(一CHO)的结构是
醛基总是在碳链的端点而不可能在两个碳原子之间。醛基(一CHO)的结构是 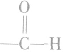 (分子中的
(分子中的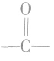 叫做羰基),电子式是
叫做羰基),电子式是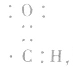 醛基可以写成
醛基可以写成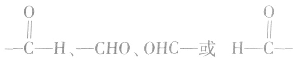 等,但不能写成
等,但不能写成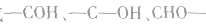 等。
等。
2,通式:饱和一元醛的通式为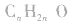 或
或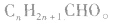 醛可以分为脂肪醛和芳香醛、一元醛和二元醛等。
醛可以分为脂肪醛和芳香醛、一元醛和二元醛等。
3.化学性质:主要有强还原性,可与弱氧化剂如银氨溶液、新制Cu(OH)2反应,生成羧酸;其氧化性一般仅限于与氢加成而生成醇。醛基比较活泼,也能发生加聚和缩聚反应。
4.检验方法:用银镜反应或与新制的Cu(OH)2共热来检验醛基.
甲醛:
1、分子结构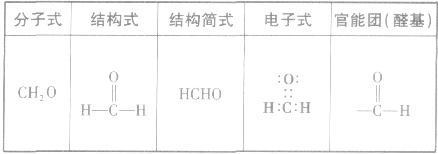
注意:甲醛属于饱和一元醛,但又相当于二元醛。 
2.物理性质
甲醛也叫蚁醛。甲醛是最简单的醛,为无色、有刺激性气味的气体,易溶于水,能跟乙醇等互溶。35%~ 40%的甲醛的水溶液俗称福尔马林,具有杀菌、防腐性能等。
注意:醛类中只有甲醛为气态(常温下)。甲醛有毒,不合格室内装修材料、家具释放的主要污染物是甲醛、苯等。
3.化学性质
(1)能被弱氧化剂氧化,最终产物为碳酸,碳酸分解产生CO2气体或生成碳酸盐。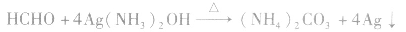
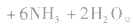

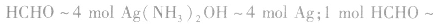
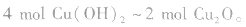
因此氧化剂的用量比乙醛多,
(2)能发生缩聚反应: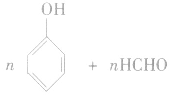
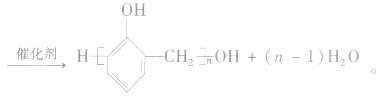
4.甲醛的用途 (1)制酚醛树脂;(2)甲醛能使蛋白质变性,具有杀菌和防腐性能。稀释的福尔马林溶液可以用来保存动物标本和尸体,用作消毒剂等。
实验室制取甲烷(CH4):
(1)反应原理:CH3COONa+NaOH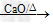 CH4+Na2CO3
CH4+Na2CO3
(2)发生装置:固+固 气
气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4 Na2SO4+2HCl?
Na2SO4+2HCl?
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
五水硫酸铜的制备:
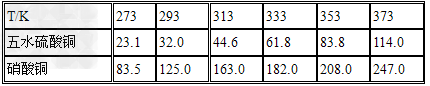
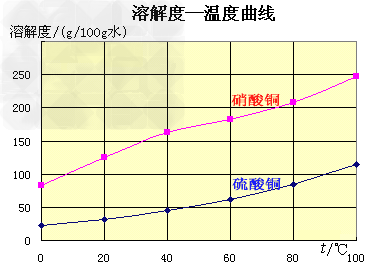
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
(1)反应原理:CH3COONa+NaOH
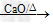 CH4+Na2CO3
CH4+Na2CO3(2)发生装置:固+固
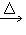 气
气 (3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4
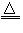 Na2SO4+2HCl?
Na2SO4+2HCl?(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
五水硫酸铜的制备:
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。


(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
发现相似题
与“某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如...”考查相似的试题有:
- 某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请完成...
- 某有机物A的化学式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有 A.2...
- 中国著名科学家王选院士总结出“科技创新之道”:“……一定要在年轻的时候养成自己动手的习惯……(他 自己)30岁以前具备了计算机...
- 下列涉及有机物的说法正确的是[ ]A.乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色B.新制氢氧化铜悬浊液可以鉴别乙酸溶液、...
- 利用下图进行有关铁与水反应的实验,并利用产物进一步制取FeCl3·6H2O晶体(图中夹持及尾气处理装置均已略去)(1)装置B中发生...
- 实验室制备溴苯可用如图所示的装置,填写下列空白:(1)关闭F夹,打开C夹,在装有少量苯的三口烧瓶中由A口加入少量溴,再加...
- (15分)现用下图所示装置及所给药品探究工业制硫酸时二氧化硫的转化率。已知C中含硫酸nmol,设气体进入C和D时能分别完全吸收某...
- 实验室制取氧气的操作步骤有:①放入药品 ②检查装置的气密性 ③将试管固定在铁架台上 ④给试管加热 ⑤移去酒精灯 ⑥用排水法收集气...
- 实验室制取气体时,吸收尾气的方案,正确的是:①向KMnO4晶体中加入浓盐酸,产生的气体进行漂白实验后的尾气用NaOH溶液吸收;②...
- 下列气体既能用浓硫酸干燥又能用碱石灰干燥的是( )A.SO2B.NH3C.N2D.CO2